
【题目】下列说法正确的是![]()
![]()
A. 氢氧燃料电池工作时,![]() 在负极上失去电子
在负极上失去电子
B. ![]() 溶液加热后,溶液的pH减小
溶液加热后,溶液的pH减小
C. 常温常压下,![]() 中含有的分子数为
中含有的分子数为![]() 个
个
D. 室温下,稀释![]() 溶液,溶液的导电能力增强
溶液,溶液的导电能力增强
科目:高中化学 来源: 题型:
【题目】二氧化硫的催化氧化原理为![]() ,反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是( )
,反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是( )
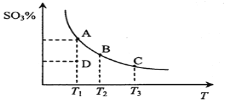
A.在D点时v正<v逆
B.反应2SO2(g)+O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
C.若B、C点的平衡常数分别为KB、KC,则KB> KC
D.恒温恒压下向平衡体系中通入氦气,平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种气体,A是密度最小的气体,B在通常情况下呈黄绿色,纯净的A可以在B中安静地燃烧生成C。把气体B通入到适量石灰乳中可以得到白色浑浊物D。请据此回答下列问题:
(1)写出下列各反应的化学方程式
①纯净的A在B中安静地燃烧生成C_______________
②将气体B通入到水中:__________。
③将气体B通入到NaOH溶液中:_______________________
④将气体B通入到适量石灰乳中:_______________________
(2)把三种气体分别通入酸性硝酸银溶液中,出现白色沉淀的气体是________(用字母表示)。
(3)将白色浑浊物D溶于水得到澄清溶液,分别取适量该澄清液两份。
①向第一份中滴加碳酸钠溶液观察到出现沉淀,发生反应的化学方程式为______________、________。
②向第二份溶液中滴加硝酸酸化的硝酸银溶液,会观察到____________(填现象)。
③白色浑浊物D因具有漂白性又称为______________,该物质在空气中容易变质的原因为_______________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。W、X、Y、Z均为短周期元素,原子序数依次增加,其中W、X、Z组成的化合物M、N、R之间存在如图所示的反应。下列叙述正确的是
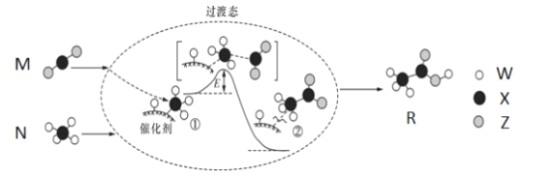
A.元素非金属性的顺序为X>Y>Z>W
B.M、N、R三种分子中,所有原子均满足8电子稳定结构
C.M、N、R三种分子均含有极性键和非极性键
D.W、X、Y、Z四种元素既可形成离子化合物,又可形成共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,可逆反应m A(g)+n B(g)![]() p C(g)+q D(g),当 m、 n、 p、q 为任意整数时,下列说法一定能说明反应已达到平衡的是( )
p C(g)+q D(g),当 m、 n、 p、q 为任意整数时,下列说法一定能说明反应已达到平衡的是( )
①体系的压强不再改变 ②体系的密度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变 ⑤反应速率 v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q ⑥单位时间内 m mol A 发生断键反应,同时 p mol C 也发生断键反应
A. ③④⑤⑥ B. ③④⑥ C. ①③④ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的信息,下列叙述正确的是( )
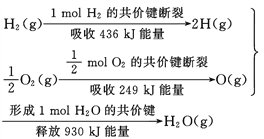
A. 2 mol H2(g)跟 1 mol O2(g)反应生成 2 mol H2O(g)吸收能量为490 kJ
B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 1 mol H2(g) 跟0.5mol O2(g) 反应生成 1 mol H2O(l)释放能量为245 kJ
D. 2molH2O (g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 | A | B | C | D |
性质 结构 信息 | 核外电子共有7种运动状态 | 原子的M层有1对成对的p电子 | 一种核素的中子数为35、质量数为64 | 有多种同位素,其中一种用做测量相对原子质量的校准 |
(1)写出B原子的电子排布式______。写出C原子的电子排布式______
(2)四种元素中非金属性最强的元素是______,金属性最强的元素是______,第一电离能最大的元素是______;
(3)一定条件下B、C单质间能反应,相应的反应方程式为______。
(4)已知S+6HNO3=H2SO4+6NO2↑+2H2O,该反应表明利用硝酸可以制取硫酸,但该反应不能用于说明氮元素的非金属性比硫元素的强,理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将amol氮气与bmol氢气的混合气体通入一个固定容积的密闭容器中,发生反应N2(g)+3H2(g) ![]() 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a值为________。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中氨气体积分数为25%,平衡时氨气的物质的量为________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同)n始∶n平=______。
(4)原气体中a∶b=________。
(5)达到平衡时混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10 mL 0.10molL1-1YOH溶液中逐渐滴加0.20molL-1HX 溶液,混合溶液的pH 变化如图所示(温度和体积变化忽硌不计)。下列结论错误的是
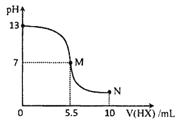
A.HX为一元弱酸,YOH 为一元强碱
B.M点对应溶液中水的电离程度大于N 点溶液中水的电离程度
C.N点对应溶液中粒子浓度:c(HX)> c(X - ) > c(Y+ ) > c(H+ ) > c(OH-)
D.室温时,pH = a 的YX溶液中水电离出的c(OH-)=l.0×10-(14-a)molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com