
下列有关实验装置进行的相应实验,能到达实验目的地( )
|
| A. |
除去Cl2中含有的少量HCl |
|
| B. |
蒸干FeCl3饱和溶液制备FeCl3晶体 |
|
| C. |
制取少量纯净的CO2气体 |
|
| D. |
分离CCl4萃取碘水后已分层的有机层和水层 |
| 化学实验方案的评价. | |
| 专题: | 实验评价题. |
| 分析: | A.氯气和氯化氢都能与氢氧化钠反应; B.氯化铁在加热时水解生成氢氧化铁; C.碳酸钠为固体粉末不是块状固体; D.有机层和水层不溶. |
| 解答: | 解:A.氯气和氯化氢都能与氢氧化钠反应,将原物质除掉,故A错误; B.氯化铁在加热时水解生成氢氧化铁,不能直接用蒸发的方法制备,故B错误; C.碳酸钠为固体粉末不是块状固体,会从多孔塑料板上漏下,故C错误; D.有机层和水层不溶,能分层,可用分液漏斗分离,故D正确. 故选D. |
| 点评: | 本题考查实验方案的评价,侧重于物质的分离、制备以及收集,题目难度不大,注意相关物质的性质的把握. |


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
化学反应的实质就是旧键的断裂和新键的形成。欲探讨发生化学反应时分子中化学键在何处断裂的问题,近代科技常用同位素示踪原子法。如有下列反应:
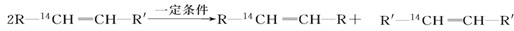

可以推知,物质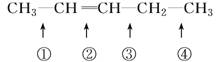 发生此反应时断裂的化学键应是( )
发生此反应时断裂的化学键应是( )
A.①③ B.①④ C.② D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合硫酸铁(SPFS)是一种新型的饮用水处理剂和城市污水净化剂,其化学组成可表示为[Fe2(OH)n(SO4)3-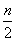 ]m。某研究小组将聚合硫酸铁在一定条件下加热完全分解,对所得气体产物和固体产物进行实验探究。请利用实验室常用仪器、用品和以下试剂完成验证和探究过程(已知SO3的熔点为16.8 ℃)。
]m。某研究小组将聚合硫酸铁在一定条件下加热完全分解,对所得气体产物和固体产物进行实验探究。请利用实验室常用仪器、用品和以下试剂完成验证和探究过程(已知SO3的熔点为16.8 ℃)。
试剂:1.0 mol·L-1的盐酸、1.0 mol·L-1的KMnO4溶液、0.1 mol·L-1的BaCl2溶液、20%的KSCN溶液、品红溶液、蒸馏水、冰水。
(1)聚合硫酸铁中铁元素的化合价是________。
(2)固体产物成分的探究
 实验设计
实验设计
| 实验步骤 | 现象 |
| 步骤1:取适量的固体产物于试管中,加入足量1.0 mol·L-1的盐酸,充分振荡使固体完全溶解 | 固体溶解,没有观察到气泡,溶液呈黄色 |
| 步骤2:取少量步骤1所得溶液于试管中,加入适量20%的KSCN溶液,振荡 | 溶液呈血红色 |
| 步骤3:另取少量步骤1所得溶液于试管中,滴入少量1.0 mol·L-1的KMnO4溶液,振荡 | KMnO4的紫红色不褪去 |
 思考与判断
思考与判断
根据上面的信息,可以确定固体产物的成分是________;步骤1中发生反应的离子方程式为
______________________________________________________________。
(3)气体产物成分的探究(不考虑水蒸气)
 提出假设
提出假设
假设1:所得气体的成分是SO3;
假设2:所得气体的成分是SO2、O2;
假设3:所得气体的成分是________。
 设计实验方案,验证假设
设计实验方案,验证假设
按下表的实验步骤写出预期现象与结论。
| 实验操作 | 预期现象与结论 |
| 步骤1:将少量气体产物通入盛有适量品红溶液的试管中,观察溶液的颜色变化,然后加热再观察溶液的颜色变化 | ①若____________,则________成立 ②若____________,则________成立 |
| 步骤2:将气体产物缓缓通过浸在冰水中的U形
| 结合上述步骤1的有关结论__________(填①或②) ①若____________,则____成立 ②若____________,则____成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
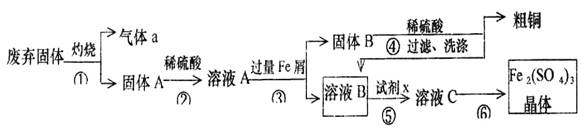
(1)除酒精灯和铁架台或三脚架外,①中所需的容器名称为 ;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式为 ;
(3)写出步骤③发生反应的离子方程式 ;
(4)步骤⑥的实验操作为 、过滤、烘干。
(5)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的
SCN—被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol/L硫酸、1.0 mol/LNaOH溶液、0.1 mol/LFe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合趣实验验证乙同学的猜测是否合理。简要说明实验步骤和现象
。
查看答案和解析>>
科目:高中化学 来源: 题型:
“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是 ①实验室收集氨气采用图所示装置 ②实验室中做氯气与钠的反应实验时采用图所示装置 ③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验 ④实验室中采用图所示装置进行铜与稀硝酸的反应( )
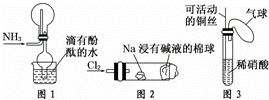
A.②③④ B. ①②③ C. ①②④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于浓硫酸的叙述不正确的是( )
|
| A. | 浓硫酸具有脱水性,因而能使蔗糖炭化 |
|
| B. | 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 |
|
| C. | 浓硫酸是一种干燥剂,能够干燥二氧化硫、氢气等气体 |
|
| D. | 浓硫酸在常温下能够使铁、铝等金属钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
|
| A. | 在自然界中只以化合态的形式存在 | B. | 单质常用作半导体材料和光导纤维 |
|
| C. | 最高价氧化物不与酸反应 | D. | 气态氢化物比甲烷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
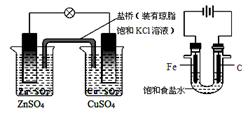
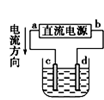
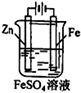
① ② ③ ④
A.图①铜锌原电池工作时,盐桥中的K+移向ZnSO4溶液
B.图②装置反应一段时间,将湿润的KI淀粉试纸靠近碳电极管口,试纸变蓝
C.用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
D.用装置④可进行铁片镀锌
查看答案和解析>>
科目:高中化学 来源: 题型:
化学上有许多方法可以用于
鉴别食盐和“工业盐”,下列方法可行的是:
①加入稀硫酸,微热,看能否产生红棕色气体。②加入酸化的碘化钾淀粉溶液,看溶液是否变蓝。③加入酸化的氯化亚铁溶液,看溶液是否变成棕黄色。④加入酸性高锰酸钾溶液,看能否褪色。⑤加入硝酸酸化的硝酸银溶液,看能否产生白色沉淀。
A.只有①②③④ B.只有②③④⑤ C.只有③④⑤ D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com