
 ,
, ;
;
| ||
| △ |
| ||
| △ |


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
| A、①②③⑤ | B、①②③④ |
| C、②③④⑤ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体积:④<①<③<② |
| B、氢原子数:②<④<③<① |
| C、质量:①<④<③<② |
| D、密度:①<④<③<② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢键属于化学键,但比较弱 |
| B、任何物质中都一定含有化学键 |
| C、NaOH中有离子键和共价键,则NaOH既属于离子化合物,又属于共价化合物 |
| D、H2O2中既有极性键,又有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
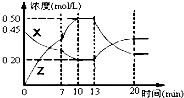 向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g)△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息判断,下列说法中正确的是( )
向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g)△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息判断,下列说法中正确的是( )| A、用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L?min) |
| B、化学方程式中a:b=1:3 |
| C、推测在第7min时曲线变化的原因可能是增加X的浓度 |
| D、推测该反应处于化学平衡状态的时间是10min--13min及第20min后 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol?L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
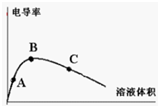 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.| 醋酸浓度(mol?L-1) | 0.0010 | 0.100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
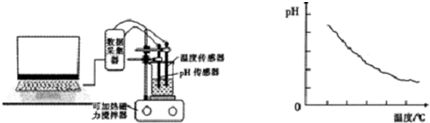
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com