
【题目】微型银-锌电池可用作电子仪器的电源,其电极分别是![]() 和
和![]() ,电解质为
,电解质为![]() 溶液,电池总反应为
溶液,电池总反应为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.电池工作过程中,![]() 溶液浓度降低
溶液浓度降低
B.电池工作过程中,电解液中![]() 向正极迁移
向正极迁移
C.负极发生反应![]()
D.正极发生反应![]()
【答案】C
【解析】
根据电池总反应可知,Zn失电子、发生氧化反应而作负极,氧化银得到电子、发生还原反应作正极,负极电极反应式为Zn+2OH--2e-=Zn(OH)2,正极电极反应式为Ag2O+H2O+2e-═2Ag+2OH-,放电时,电解质溶液中阴离子向负极移动、阳离子向正极移动。
A.由电池总反应为Ag2O+Zn+H2O═2Ag+Zn(OH)2可知,反应中n(KOH)不变,但电池反应消耗了H2O,所以电池工作过程中,KOH溶液浓度升高,故A错误;
B.电池工作过程中,电解质溶液中阴离子向负极移动、阳离子向正极移动,所以电解液中OH-向负极迁移,故B错误;
C.由电池总反应可知,Zn失电子、发生氧化反应而作负极,电极反应式为Zn+2OH--2e-=Zn(OH)2,故C正确;
D.氧化银得到电子、发生还原反应作正极,注意反应是在碱性条件下进行,电极反应式为Ag2O+H2O+2e-═2Ag+2OH-,故D错误;
故选:C。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】氧气是一种常见的氧化剂,用途广泛。回答下列问题:
(1)用H2O2制取O2时,分解的热化学方程式为:2H2O2(aq)=2H2O(l)+O2(g) ΔH=akJ·mol-1
①相同条件下,H2O2分解时,使用催化剂,不会改变的是___(填标号)。
A.反应热 B.反应速率 C.活化能 D.生成物
②以Fe3+作催化剂时,H2O2的分解反应分两步进行,第一步反应为:H2O2+2Fe3+=2Fe2++O2+2H+,第二步反应的化学方程式为___。
(2)已知:O2(g)+4HCl(g)![]() 2Cl2(g) + 2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g) + 2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。

①该反应的速率v=k ca(O2)·cb(HCl)(k为速率常数),下列说法正确的是___(填标号)。
A.温度升高,k增大
B.使用催化剂,k不变
C.平衡后分离出水蒸气,k变小
D.平衡后再充入1molO2和4molHCl,反应物转化率都增大
②T1___T2(填“>”或“<”)。该反应的ΔH___0(填“>”或“<”)。
③T2时,HCl的平衡转化率=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
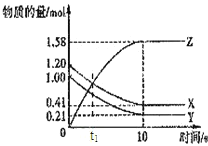
A.反应在0~10s内,用Z表示的反应速率为0.158moL/(Ls)
B.反应进行到10s时,Y的转化率为79.0%
C.反应的化学方程式为:X(g)+Y(g)Z(g)
D.容器内气体压强不再变化时反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)表示核素的符号共______种。
(2)互为同位素的是________________。
(3)质量相同的H216O和D216O所含中子数之比为________。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式:___________________________。
(5)Be(OH)2与Mg(OH)2可用____________________试剂鉴别。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向Na2SO4溶液中先加硝酸酸化,再加BaCl2溶液 | 无明显现象 | 不能用硝酸和BaCl2溶液检验SO |
B | 向AlCl3溶液中滴加过量氨水 | 溶液澄清 | AlCl3与NH3·H2O能大量共存 |
C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏伽德罗常数的数值,下列说法不正确的是( )
A.1 L1mol/L H2SO4,含有2NA个H+
B.500mL2mol/L盐酸比100mL2mol/L硫酸的导电性强
C.1mol Na2S2,含NA个共价键
D.标准状况下,3.36 LSO2的质量约为9.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氢氧燃料电池放电时化学能全部转化为电能
B. 反应4Fe(s)+3O2(g)![]() 2Fe2O3(s)常温下可自发进行,该反应为吸热反应
2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C. 3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D. 在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以环戊烷为原料制备环戊二烯的合成路线如图,则下列说法正确的是( )
![]()
A. A的结构简式是![]()
B. ①②的反应类型分别是取代、消去
C. 反应②③的条件分别是浓硫酸加热、光照
D. 加入酸性KMnO4溶液,若溶液褪色则可证明![]() 已完全转化为
已完全转化为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关工业生产的叙述正确的是
A.合成氨生产中将![]() 液化分离,可增大反应速率,提高
液化分离,可增大反应速率,提高![]() 、
、![]() 的转化率
的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用![]() 转化为
转化为![]() 时放出的热量
时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的![]() 进入阳极室
进入阳极室
D.侯氏制碱法是将氨气和二氧化碳先后通入饱和氯化钠溶液中,制得碳酸氢钠固体,再在高温下灼烧,转化为碳酸钠固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com