
【题目】有CuO,Fe、H2、Ba(OH)2溶液、K2CO3溶液、NaOH溶液、稀硫酸七种物质,在常温下两种物质两两间能发生反应最多有( )
A.4个
B.5个
C.6个
D.7个
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
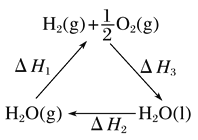
mCeO2![]() (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是( )
A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 如图中ΔH1=ΔH2+ΔH3
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中。

①ⅡA族元素的最外层电子数__________。
②第三周期元素的最高正价__________。
③F-、Na+、Mg2+、Al3+的离子半径__________。
(2)用A+、B-、C2-、D分别表示含有18电子的4种微粒(离子或分子)
①A+、B-、C2-半径由大到小顺序为__________。(填离子符号)
②D分子中含有4个原子,其电子式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 ( )
2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 ( )
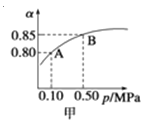
A.由图甲知,A点SO2的平衡浓度为0.4 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,v正 和v逆 都增大
D.增大SO2浓度,v正 增大v逆 减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图海水综合利用的工业流程图,判断下列说法正确的是( )
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
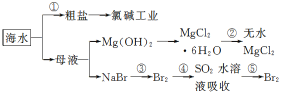
A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D.从第③步到第⑤步的目的是为了制取并提纯Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向H2C2O4溶液中逐滴加入NaOH溶液,所得溶液中H2C2O4,HC2O4-,C2O42-三者物质的量分数(分布系数)随pH变化的关系入左图所示。右图为不同浓度NaHC2O4溶液中部分微粒浓度。下列表述错误的是
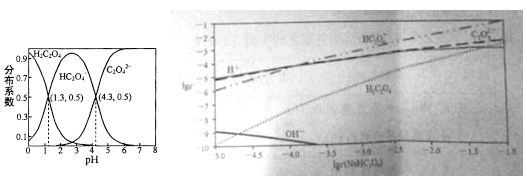
A. HC2O4-![]() H++C2O42- K=1×10-4.3
H++C2O42- K=1×10-4.3
B. 将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液pH恰好为4.3
C. NaHC2O4溶液中一定存在c(C2O42-)>c(H2C2O4),同时c(H+)>c(OH-)
D. 在0.1mol/L NaHC2O4溶液中各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)> c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1CH3COOH溶液过程中溶液pH的变化曲线。AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是

A.c(OH-)一定大于c(CH3COO-) B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-) D.c(OH-)大于、小于或等于c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com