
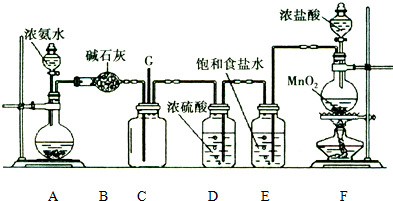
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓盐酸 | MnO2 | NaOH | 制氯气并吸收尾气 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化锰与浓盐酸需在加热条件下才能反应;
B.浓硫酸具有脱水性及强氧化性,蔗糖脱水得到C与浓硫酸发生氧化还原反应生成二氧化硫,二氧化硫与溴水发生氧化还原反应生成硫酸和HBr;
C.稀盐酸与亚硫酸钠生成二氧化硫,在③中二氧化硫与Ba(NO3)2溶液发生氧化还原反应生成硫酸钡;
D.浓硝酸易挥发,则③中可能发生硝酸与硅酸钠的反应.
解答 解:A.二氧化锰与浓盐酸反应需要加热,图中缺少加热装置,故A错误;
B.蔗糖与浓硫酸混合,蔗糖脱水得到C与浓硫酸发生氧化还原反应生成二氧化硫,二氧化硫与溴水发生氧化还原反应生成硫酸和HBr,则由实验可知浓硫酸具有脱水性、氧化性,故B正确;
C.稀盐酸与亚硫酸钠生成二氧化硫,在③中二氧化硫与Ba(NO3)2溶液发生氧化还原反应生成硫酸钡,则结论不合理,如二氧化硫与氯化钡不反应,故C错误;
D.浓硝酸易挥发,则③中可能发生硝酸与硅酸钠的反应,则不能比较酸性碳酸>硅酸,故D错误;
故选B.
点评 本题考查实验装置的综合应用,为高频考点,题目难度中等,侧重于学生的分析能力和实验能力的考查,涉及物质的制备、酸性比较、氧化还原反应等,注意把握物质的性质以及实验的严密性的评价.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离氢氧化铁胶体和氯离子 | 过滤 | 胶体不能透过半透膜,离子能 |
| B | 除去乙醇中的乙酸 | 蒸馏 | 先加生石灰,利用乙醇与乙酸盐沸点相差较大 |
| C | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
| D | 分离植物油和水的混合物 | 分液 | 二者互不相溶且沸点不同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH→H++CH3COO- | B. | NaHCO3→Na++HCO3- | ||
| C. | NH4Cl→NH4++Cl- | D. | H2S  H++HS- H++HS- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,3.2gO2所含的原子数为0.2NA | |
| B. | 标准状况下,18gH2O所含的氧原子数目为NA | |
| C. | 常温常压下,92gNO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝易氧化,但氧化铝具有保护内部铝的作用 | |
| B. | 铝的氧化物容易发生还原反应 | |
| C. | 铝不易被氧化 | |
| D. | 铝不易发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ |
| 开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com