
| A. | 制造普通玻璃的主要原料是纯碱、石灰石和石英 | |
| B. | 盛放烧碱溶液的试剂瓶不能用玻璃塞 | |
| C. | 玻璃在加热熔化时有固定的熔点 | |
| D. | 普通玻璃的主要成分是硅酸钠、硅酸钙和二氧化硅 |
分析 A、生产玻璃的原料有:纯碱、石灰石和石英;
B、二氧化硅属于酸性氧化物,可以和强碱反应;∽
C、混合物没有固定的熔沸点;
D、普通玻璃的主要成分是硅酸钠、硅酸钙和二氧化硅.
解答 解:A、工业上生产玻璃的原料有:纯碱、石灰石和石英,故A正确;
B、二氧化硅属于酸性氧化物,可以和强碱氢氧化钠反应,生成硅酸钠,具有粘性,能将瓶口和瓶塞黏在一起,所以盛放烧碱溶液的试剂瓶不能用玻璃塞,故B正确;
C、玻璃的成分是硅酸钠、硅酸钙和二氧化硅,属于混合物,在加热熔化时没有固定的熔沸点,故C错误;
D、制造普通玻璃的原料是石英、石灰石和纯碱,制出的普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅,故D正确.
故选C.
点评 本题考查玻璃的制备、成分以及二氧化硅的性质方面的知识,较基础,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2的溶解度最小 | |
| B. | Ca(OH)2的溶解度最小 | |
| C. | AgCl的溶解度最小 | |
| D. | 同一温度下Ksp越大的溶解度也越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象及结论 |
| 取少量C中反应后溶液于试管中,加入铜粉(或BaCl2溶液) | 若铜粉溶解,溶液变蓝色(或无沉淀),则猜想2正确;若铜粉不溶解(或产生白色沉淀),则猜想1正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
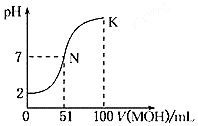 常温下,向100mL0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化勿略不计).下列说法中正确的是( )
常温下,向100mL0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化勿略不计).下列说法中正确的是( )| A. | 该滴定过程可选择酚酞作为指示剂 | |
| B. | HA的电离方程式为:HA?H++A- | |
| C. | K点溶液中:c (MOH)+c(OH-)-c(H+)=0.01mol•L-1 | |
| D. | N点水的电离程度大于K点水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Zn | ZnO | ZnS | CuS | BaSO4 | H2S | |
| 熔点/℃ | 419.5 | 1975(同时分解) | - | - | - | - |
| 沸点/℃ | 907 | - | - | - | - | - |
| Ksp(常温) | - | - | 2.5×10-21 | 6.4×10-35 | 1.1×10-10 | K1=1.1×10-7 K2=1.3×10-13 |
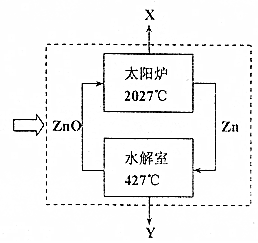
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
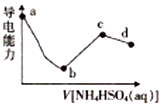 向一定浓度的Ba(OH)2溶液中滴入某浓度的NH4HSO4溶液,其导电能力随滴入溶液体积的变化如图所示.下列说法正确的是( )
向一定浓度的Ba(OH)2溶液中滴入某浓度的NH4HSO4溶液,其导电能力随滴入溶液体积的变化如图所示.下列说法正确的是( )| A. | b点溶液中只存在H2O的电离平衡和BaSO4的沉淀溶解平衡 | |
| B. | c 点滚液中:c(H+)+c(NH4+)=c(NH3•H2O)+c(OH-) | |
| C. | ab段反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | bc段之间存在某点,其溶液中:c(NH4+)=2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
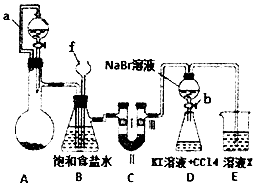 实验是化学研究的重要方法之一,某同学为了制备氯气并探究氯气等物质的相关性质,设计如图所示的实验方案:
实验是化学研究的重要方法之一,某同学为了制备氯气并探究氯气等物质的相关性质,设计如图所示的实验方案:| ① | ② | ③ | ④ | |
| I | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| II | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| II! | 干燥的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 干燥的红纸条 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com