
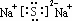 ;其水溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+).
;其水溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+).分析 W、X、Y、Z是原子序数依次增大的同一周期元素,W、X是金属元素,Y、Z是非金属元素.
(1)W、X各自的氧化物对应的水化物可以反应生成盐和水,可推知W为Na、X为Al;
(2)W(Na)与Y可形成化合物W2Y,Y表现-2价,则Y为S,形成的化合物为Na2S,属于离子化合物,溶液中硫离子水解,溶液呈碱性,溶液中氢氧根离子源于水的电离、硫离子与HS-的水解,离子水解微弱;
(3)硝酸铝溶液中Al3+离子水解,破坏水的电离平衡,溶液呈酸性;
(4)结合原子序数可知Z为Cl,S的低价氧化物通入氯气的水溶液中,应为二氧化硫与氯气反应生成硫酸与HCl;
(5)Z的最高价氧化物为是Cl2O7,Cl2O7和水反应生成高氯酸,0.25molCl2O7和水反应放出QkJ热量,则1molCl2O7和水反应放出4QkJ热量,注明物质聚集状态与反应热书写热化学方程式.
解答 解:W、X、Y、Z是原子序数依次增大的同一周期元素,W、X是金属元素,Y、Z是非金属元素.
(1)W、X各自的氧化物对应的水化物可以反应生成盐和水,可推知W为Na、X为Al,为NaOH和Al(OH)3,二者反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)W(Na)与Y可形成化合物W2Y,Y表现-2价,则Y为S,形成的化合物为Na2S,属于离子化合物,电子式为: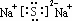 ,溶液中硫离子水解,溶液呈碱性,溶液中氢氧根离子源于水的电离、硫离子与HS-的水解,溶液中离子浓度大小为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),
,溶液中硫离子水解,溶液呈碱性,溶液中氢氧根离子源于水的电离、硫离子与HS-的水解,溶液中离子浓度大小为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),
故答案为: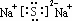 ;c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);
;c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);
(3)硝酸铝溶液中Al3+离子水解:Al3++3H2O═Al(OH)3+3H+,破坏水的电离平衡,溶液呈酸性,
故答案为:酸;Al3++3H2O═Al(OH)3+3H+;
(4)结合原子序数可知Z为Cl,S的低价氧化物通入氯气的水溶液中,应为二氧化硫与氯气反应生成硫酸与HCl,反应化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(5)Z的最高价氧化物为是Cl2O7,Cl2O7和水反应生成高氯酸,0.25molCl2O7和水反应放出QkJ热量,则1molCl2O7和水反应放出4QkJ热量,所以其热化学反应方程式为:Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol,
故答案为:Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol.
点评 本题考查结构性质位置关系应用,涉及电子式、盐类水解、热化学方程式书写等,正确推断元素是解本题关键,注意掌握离子浓度大小的比较方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(ClO)2(aq)$\stackrel{CO_{2}}{→}$HClO(aq)$\stackrel{光照}{→}$HCl(aq) | |
| B. | NaCl(饱和)$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | Al2O3$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| D. | NaAlO2(aq)$\stackrel{过量盐酸}{→}$AlCl3$\stackrel{电解}{→}$Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH只适用于稀溶液,对于c(H+)>1 mol/L时,一般不用pH而直接用H+的浓度表示 | |
| B. | 水的电离、弱酸、弱碱的电离及盐类水解都是吸热的 | |
| C. | pH每增加一个单位,c(H+) 则减少10倍 | |
| D. | 25℃纯水中加入盐酸后,pH<7,此时水的离子积常数KW≠1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠在电流的作用下电离出Na+和Cl- | |
| B. | CaCO3难溶于水,但CaCO3属于强电解质 | |
| C. | 二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质 | |
| D. | 硫酸钠在水中的电离方程式可表示为Na2SO4═2Na++S6++4O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na和AlCl3溶液反应 | B. | 最高价氧化物对应水化物的碱性 | ||
| C. | 单质与H2O反应的难易程度 | D. | 同浓度NaCl和AlCl3溶液的pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com