
| 阳离子 | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
| 沉淀完全时的pH | 3.2 | 5.2 | 11.0 |
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| ||
| A、64g/mol |
| B、24g/mol |
| C、65g/mol |
| D、40g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三者对应的氧化物均为酸性氧化物 |
| B、实验室可用NaOH溶液处理SO2、NO2 |
| C、CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
| D、三者的单质直接与氧气反应都能生成两种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
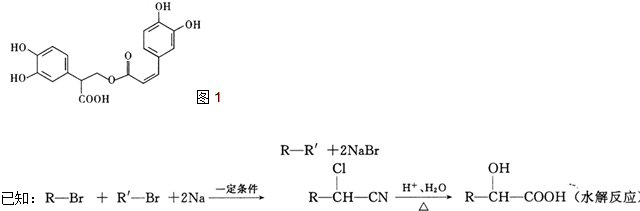
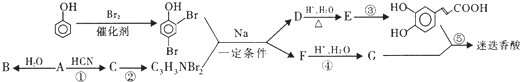
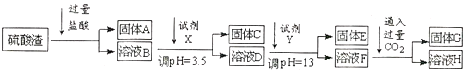
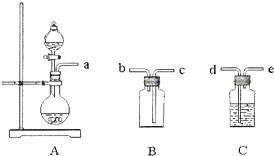
查看答案和解析>>
科目:高中化学 来源: 题型:
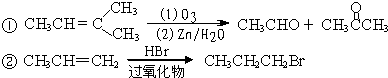
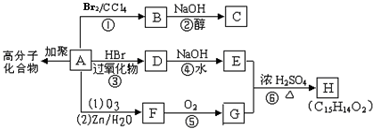
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2?H2的转化率 |
| B、工业上利用电解熔融的氧化铝制取铝,电解熔融的氧化镁制取镁 |
| C、电解精炼铜时,同一时间内阴极溶解铜的质量比阳极析出铜的质量小 |
| D、从海带中提取碘单质的实验中,要经过煅烧、溶解、过滤和萃取等操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量固体产物于试管中,加入足量蒸馏水溶解,过滤,分离出不溶固体 | |
| 步骤2:取少量上述不溶固体放入试管中,加入足量CuSO4溶液,充分振荡. | 若固体无明显变化,则假设 |
| 步骤3: | 若溶液基本无色,则假设Ⅰ成立,若溶液呈浅绿色,则假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
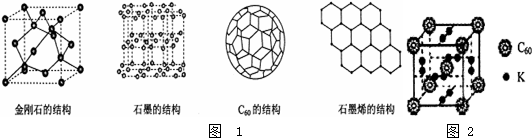
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com