
 工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.
工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.分析 (1)由Cr2O72-~2Cr3+~6e-,SO2~SO42-~2e-,可得Cr2O72-~3SO2,根据关系式计算;
(2)根据Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=1×10-30计算c(OH-),再结合水的离子积计算c(H+),根据pH=-lgc(H+)计算;
(3)温度升高过氧化氢分解平衡逆向进行;
(4)n(KMnO4)=0.4000mol/L×20ml×10-3L/ml=8.000×10-3mol,
n(Fe2+)=5×8.000×10-3mol=0.04000mol,依据发盐的化学式可知在久置的发盐中n(Al3+)=2×[0.04000mol+n(Fe3+)],
加入氨水后生成的干燥固体粉末中:
n(Al2O3)=0.04000mol+n(Fe3+)
n(Fe2O3)=$\frac{1}{2}$[0.04000mol+n(Fe3+)]
102g/mol×[0.04000mol+n(Fe3+)]+160g/mol×$\frac{1}{2}$×[0.04000mol+n(Fe3+)]=9.10g
n(Fe3+)=001000mol
n(Al3+)=2×[0.04000mol+n(Fe3+)]=0.1000mol
n(SO42-)=2n(Al3+)=0.2000mol
久置的发盐中的阳离子所带电荷总数:3n(Al3+)+2n(Fe2+)+3n(Fe3+)=0.4100mol
而已知的阴离子所带电荷总数2n(SO42-)=0.4000mol<0.4100mol,由于发盐在空气中被氧化,故其中还可能存在0.01000molOH-或0.00500molCO32-,据此书写化学式.
解答 解:(1)100LCr2O72-含量为108mg•L-1的含铬废水中含Cr2O72-物质的质量=100L×108mg•L-1的=10800mg=10.8g,物质的量n(Cr2O72-)=$\frac{10.8g}{216g/mol}$=0.05mol,
根据电子转移守恒:Cr2O72-~3SO2~6e-;
1 3
0.05mol n
所以n=0.15mol,
标准状况下体积=22.4L/mol×0.15mol=3.36L,
故答案为:3.36;
(2)室温下,除去被SO2还原所得溶液中的Cr3+(使其浓度小于1×10-6mol•L-1),Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=1×10-30,则c(OH-)=10-8mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-8}}$=10-6mol/L,则pH=6,需调节溶液pH>6,
故答案为:>6;
(3)三价铬Cr(Ⅲ)与双氧水反应可用于合成铬黄(PbCrO4),发生的是氧化还原反应,图象分析可知反应达到平衡状态达到最大转化率,温度升高超过70℃时过氧化氢分解,使平衡逆向进行,Cr(Ⅲ)转化率下降,
故答案为:较高温度下双氧水分解;
(4)n(KMnO4)=0.4000mol/L×20ml×10-3L/ml=8.000×10-3mol,
n(Fe2+)=5×8.000×10-3mol=0.04000mol,依据发盐的化学式可知在久置的发盐中n(Al3+)=2×[0.04000mol+n(Fe3+)],
加入氨水后生成的干燥固体粉末中:
n(Al2O3)=0.04000mol+n(Fe3+)
n(Fe2O3)=$\frac{1}{2}$[0.04000mol+n(Fe3+)]
102g/mol×[0.04000mol+n(Fe3+)]+160g/mol×$\frac{1}{2}$×[0.04000mol+n(Fe3+)]=9.10g
n(Fe3+)=001000mol
n(Al3+)=2×[0.04000mol+n(Fe3+)]=0.1000mol
n(SO42-)=2n(Al3+)=0.2000mol
久置的发盐中的阳离子所带电荷总数:3n(Al3+)+2n(Fe2+)+3n(Fe3+)=0.4100mol
而已知的阴离子所带电荷总数2n(SO42-)=0.4000mol<0.4100mol,由于发盐在空气中被氧化,故其中还可能存在0.01000molOH-或0.00500molCO32-,
该发盐的可能组成为n(Al3+):[n(Fe2+)+n(Fe3+)]:n(OH-):n(SO42-)=0.1:0.05:0.01:0.2=10:5:1:20,化学式为:Al10Fe5(OH)(SO4)20,
n(Al3+):[n(Fe2+)+n(Fe3+)]:n(CO32-):n(SO42-)=0.1:0.05:0.005:0.2=20:10:1:40,化学式为Al20Fe10(CO3)(SO4)40,
答:该久置发盐的可能化学组成为Al10Fe5(OH)(SO4)20或Al20Fe10(CO3)(SO4)40.
点评 本题考查了物质组成的实验探究、溶度积常数计算、化学式计算应用、氧化还原反应定量计算的分析判断,掌握基础是解题关键,题目难度较大.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
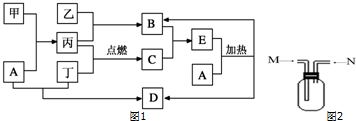
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
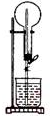 如图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴定管内盛放某种液体.挤压滴管的胶头,下列与实验事实不相符的是( )
如图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴定管内盛放某种液体.挤压滴管的胶头,下列与实验事实不相符的是( )| A. | CO2(NaOH溶液)/无色喷泉 | B. | NH3(H2O含石蕊)/红色喷泉 | ||
| C. | H2S(CuSO4溶液)/黑色喷泉 | D. | HCl(AgNO3溶液)/白色喷泉 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
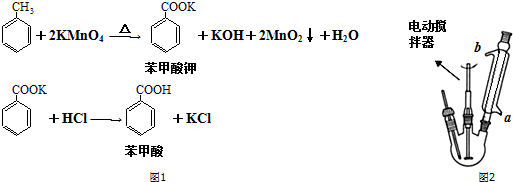
| 化合物 | 相对分子质量 | 密度(g•cm-3) | 溶解性 | 沸点(℃) |
甲苯 | 92 | 0.87 | 难溶于水 | 110.0 |
| 苯甲酸钾 | 160 | - | 易溶于水 | - |
| 苯甲酸 | 122 | 1.26 | 微溶于水 | 248.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和乙烯 | B. | 乙烷和乙烯 | C. | 甲烷和丙烯 | D. | 甲烷和丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇分子中 | B. | 乙酸和乙酸乙酯分子中 | ||
| C. | 乙醇和乙酸乙酯分子中 | D. | 乙酸分子中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
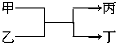 若甲、丙为短周期、同一主族元素形成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为①钠和氢气 ②氟气和氧气 ③碳和硅 ④氯气和液溴( )
若甲、丙为短周期、同一主族元素形成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为①钠和氢气 ②氟气和氧气 ③碳和硅 ④氯气和液溴( )| A. | ①③ | B. | ①④ | C. | ③ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com