
 ;
; ;指出分子中化学键是共价键(填‘离子键’或‘共价键’).
;指出分子中化学键是共价键(填‘离子键’或‘共价键’).分析 (1)氮元素是7号元素,原子结构示意图为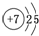 ,根据电子层数等于周期数,最外层电子数等于主族数判断;
,根据电子层数等于周期数,最外层电子数等于主族数判断;
(2)氨分子的分子式为NH3,氮与氢原子之间通过共价键结合,据此书写电子式;
(3)氮气与氢气在高温高压催化剂条件下合成氨;该反应是放热反应,则反应物的总能量大于生成物的总能量.
解答 解:(1)氮元素是7号元素,原子结构示意图为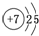 ,因为电子层数等于周期数,最外层电子数等于主族数,所以氮元素在周期表中的位置是第2周期ⅤA族,
,因为电子层数等于周期数,最外层电子数等于主族数,所以氮元素在周期表中的位置是第2周期ⅤA族,
故答案为:第2周期ⅤA族;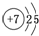 ;
;
(2)氨分子的分子式为NH3,氮与氢原子之间通过共价键结合,电子式为 ,故答案为:
,故答案为: ;共价键;
;共价键;
(3)氮气与氢气在高温高压催化剂条件下合成氨,方程式为:N2+3H2$?_{高温高压}^{催化剂}$2NH3;因为反应是放热反应,则反应物的总能量大于生成物的总能量,所以相同条件下“1molN2和3molH2”的能量与“2molNH3”的能量较高的是1molN2和3molH2,
故答案为:N2+3H2$?_{高温高压}^{催化剂}$2NH3;1molN2和3molH2.
点评 本题考查工业合成氨原理、原子结构示意图、电子式及化学方程式的书写,题目难度中等,明确常见化学用语的表示方法为解答关键,注意掌握合成氨的反应原理,试题培养了学生的灵活应用能力.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
 2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素.已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是( )
2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素.已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是( )| A. | 分子式为C15H22O5 | |
| B. | 能够发生水解反应 | |
| C. | 每个分子中含有4个六元环 | |
| D. | 青蒿素能够治疗疟疾可能与结构中存在过氧键基团有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中含有碳碳双键 | |
| B. | 易被酸性KMnO4溶液氧化 | |
| C. | 与溴水发生加成反应而使溴水褪色 | |
| D. | 在一定条件下可与浓硝酸和浓硫酸的混合酸反应生成硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 改变条件 | 速率变化 |
| 降低温度 | |
| 增大O2的浓度 | |
| 使用V2O5做催化剂 | |
| 压缩气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物安全沉淀 | 3.2 | 9.0 | 6.7 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com