
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s、灰) Sn(s、白) △H3=+2.1kJ/mol
Sn(s、白) △H3=+2.1kJ/mol
下列说法正确的是
A △H1>△H2
B 锡在常温下以灰锡状态存在
C 灰锡转化为白锡的反应是放热反应
D 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:

请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为______________________________。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为_____________________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入_______________(填试剂名称)。
(4)滤液D产生沉淀F的离子方程式为______________________________。
(5)滤液E、K中溶质的主要成分是____(填化学式),写出该溶质的一种用途_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
金银花是治疗和预防甲型H1N1的常见中草药,有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构式见右图,下列有关绿原酸的说法不正确的是( )
A.分子式为C16H18O9
B.1mol绿原酸与溴水反应最多消耗4molBr2
C.1mol绿原酸最多与5molH2加成
D.1mol绿原酸最多与4molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备BaCl2的工艺流程图如下:

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s)  4CO(g) + BaS(s) △H1 = 571.2
4CO(g) + BaS(s) △H1 = 571.2 kJ·mol-1 ①
kJ·mol-1 ①
BaSO4(s) + 2C(s)  2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,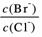 = 。
= 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s) + CO2(g)  2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是 , 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJ B.557 kJ
C. 436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/ kJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
⑴ 比较下列两组物质的熔点高低(填>或<)
SiC______ Si; SiCl4 ______ SiO2
⑵ 图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。

⑶ 工业上高纯硅可通过下列反应制取:
SiCl4 (g) + 2H2(g)  Si(s) + 4HCl(g)
Si(s) + 4HCl(g)
该反应的反应热△H = ___________ KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式书写正确的是(ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)====2CO2(g)+3H2O(g);ΔH=-1 367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)====NaCl(aq)+H2O(l);ΔH=+57.3 kJ/mol(中和热)
C.S(s)+O2(g)====SO2(g);ΔH=-296.8 kJ/mol(反应热)
D.2NO2====O2+2NO;ΔH=+116.2 kJ/mol(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合硫酸铁又称聚铁,化学式为 ,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:

(1)验证固体W焙烧后产生的气体含有SO2 的方法是_____。
(2)实验室制备、收集干燥的SO2 ,所需仪器如下。装置A产生SO2 ,按气流方向连接各仪器接口,顺序为a



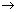 f装置D的作用是_____,装置E中NaOH溶液的作用是______。
f装置D的作用是_____,装置E中NaOH溶液的作用是______。
(3)制备绿矾时,向溶液X中加入过量_____,充分反应后,经_______操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为______。若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com