
����Ŀ��ij����ɱ���ܱ�������ʢ��������N2��H2�Ļ�����壬��һ�������·�����Ӧ��N2��g��+3 H2 ��g��![]() 2NH3��g��,��ά���¶Ⱥ�ѹǿ���䣬���ﵽƽ��ʱ�����������ΪV L,����NH3�������0.1 V L������˵����ȷ����
2NH3��g��,��ά���¶Ⱥ�ѹǿ���䣬���ﵽƽ��ʱ�����������ΪV L,����NH3�������0.1 V L������˵����ȷ����
A. ԭ�����������Ϊ1.2V L B. ��Ӧ��ƽ��ʱN2���ĵ�0.2 V L
C. ԭ�����������Ϊ1.1VL D. ��Ӧ��ƽ��ʱH2���ĵ�0.5 V L
���𰸡�C
��������
�������֮�ȵ������ʵ���֮�ȣ�����ʼ���������ΪxL������ΪyL�����ݷ�Ӧ��������ʽ���м��㲢���
����ʼ���������ΪxL������ΪyL����
N2��g��+3H2��g��![]() 2NH3��g��
2NH3��g��
��ʼ��L�� x y 0
ת����L�� 0.05V 0.15V 0.1V
ƽ�⣨L�� x-0.05V y-0.15V 0.1V
����x-0.05V+y-0.15V+0.1V=V������x+y=1.1V��
A. ԭ�����������Ϊ1.1V L��A����
B. ��Ӧ��ƽ��ʱN2���ĵ�0.05V L��B����
C. ԭ�����������Ϊ1.1V L��C��ȷ��
D. ��Ӧ��ƽ��ʱH2���ĵ�0.15V L��D����
��ѡC��


 �����ҵ���������ͯ������ϵ�д�
�����ҵ���������ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ɸ�������ɺ����ʽ��з��࣬

��1����ͼ��ʾ�����ʷ����������___��
��2����K��Na��H��O��S��N�������ֻ�����Ԫ����ɺ��ʵ����ʣ��ֱ����ڱ��Тڡ��ܡ��ޡ��ࡢ����档
������� | �� | �� | �� | ������ | �⻯�� |
��ѧʽ | ��H2SO4 ��__ | ��NaOH ��___ | ��Na2SO4 ��___ | ��SO2 ��__ | ��NH3 ��__ |
��3��SO2��CO2����������������ڻ�ѧ�������кܶ����Ƶĵط�����д�������Ģ���۷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ��___��
��4����һ�ֻ�����������ᣨH3PO3�����ӽ������ĽǶȿ��������ڶ�Ԫ���ᣬ��Na2HPO3����___�Σ������Ρ���ʽ�λ��ʽ�Σ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������⣩����(��Ҫ��Ⱦ��SO2��NO��NO2)�Ĵ����ŷ�������صĴ�����Ⱦ�����ڽ����о��ɹ��Dz���������Ϊ��ԭ������������һ�廯������
(1)�����ܷ�Ӧ��SO2(g)��CO(NH2)2(aq)��2H2O(l)��1/2O2(g)��(NH2)SO4(aq)��CO2(g)����֪�÷�Ӧ���Է����У���������____(�������������������������κ��¶���)��
(2)���ϡ�����Ʊ�O3(ԭ����ͼ)�������O3�ĵ缫��ӦʽΪ______��


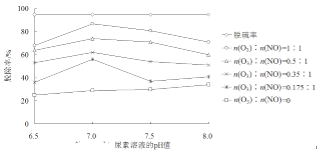
(3)�����£������ݵķ�Ӧ���м���̶����ʵ�����SO2��NO��ͨ��O3��ֻ�ϡ���Ӧ��ͬʱ�����ֵ����ʵ�����n(O3)��n(NO)�ı仯����ͼ��
�� n(NO2)��n(O3)��n(NO)�ı仯�����Ӻ���٣�ԭ����____��
�� �������Է�ӦSO2(g)��O3(g)��SO3(g)��O2(g)��Ӱ�첻�����ù���̬���۽��Ϳ���ԭ��__��
(4)ͨ�����Ʊ������о��ѳ�Ч�ʵ�Ӱ�����صõ���������ͼ��ʾ������˵����ȷ����____��
A. ������������Һ�еķ�Ӧ��v(����)��v(����)
B. ������ҺpH�ı仯������Ч�ʵ�Ӱ����ڶ�����Ч�ʵ�Ӱ��
C. ǿ���������²��������ضԵ���������ѳ�
D. pH=7��������Һ����Ч�����

(5)���ص��Ʊ���2NH3(g)��CO2(g)![]() CO(NH2)2(s)��H2O(g) ��H��0��һ�������£���10 L�����ܱ������г���2 mol NH3��1 mol CO2��
CO(NH2)2(s)��H2O(g) ��H��0��һ�������£���10 L�����ܱ������г���2 mol NH3��1 mol CO2��
�� �÷�Ӧ10 min ��ﵽƽ�⣬��������������ܶ�Ϊ4.8 g��L��1��ƽ�ⳣ��K=__��

�� ��ͼ�Ǹ������£�ϵͳ�����ص����ʵ����淴Ӧʱ��ı仯���ƣ�����Ӧʱ��ﵽ3min ʱ��Ѹ�ٽ���ϵ���£�����ͼ�л���3~10 min �����������ص����ʵ����ı仯��������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ���Ӧ�ķ���ʽ�����ϵ���
A. ��Ȼ������������ˮ�����ԣ�H2O��CO2![]() H2CO3 ��H2CO3
H2CO3 ��H2CO3![]() H+��HCO3��
H+��HCO3��
B. ��NO2������������ˮ�У���ɫ��dz��2NO2��g�� ������ɫ��![]() N2O4 ��g�� ����ɫ�� ��H��0
N2O4 ��g�� ����ɫ�� ��H��0
C. �����ȼ����Ϊ��890.3 kJ��mol��1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g����2O2��g����CO2��g��+2H2O��g�� ��H����890.3 kJ��mol-1
D. �����������Һ��ϡ�����ϳ��ֻ�����S2O32-��2H+��S ��SO2 ��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Դ�ı��⣬�̲��ŷḻ�Ļ�ѧԪ�أ����ȡ��塢��ȡ�
��1����ԭ�ӵĽṹʾ��ͼ_____����ҵ�����õ�ⱥ��ʳ��ˮ������������仯ѧ����ʽΪ_____��
��2��������ͨ��ʯ�����п���ȡƯ�ۣ���ѧ����ʽΪ_____��Ư������ˮ�Ϳ����еĶ�����̼���ã����õ���Һ������Ư�������������ɵ� HClO��������Һ��ʱ������ֻ�ʧȥƯ�����������漰�Ļ�ѧ��Ӧ����ʽΪ_____��
��3����ʢ�� KI ��Һ���Թ��м������� CCl4��μ���ˮ��CCl4������ɫ������������Թ��еμ���ˮ����CCl4 �����dz���������ɫ��
���������գ�
��a��д������ƽ CCl4������ɫ�����ɫ�Ļ�ѧ��Ӧ����ʽ�����������������������ת�Ƶķ������Ŀ��_____________
_____+_____+_____��_____HIO3+_____�÷�Ӧ�У�_____Ԫ�صĻ��ϼ����ߡ�
��b���� KI ���� KBr���� CCl4���Ϊ_____ɫ�������μ���ˮ��CCl4 �����ɫû�б仯��Cl2��HIO3��HBrO3��������ǿ������˳����_____��
��c���ӵ����к�����Ϊ 20mg��50mg/kg����ȡ�ӵ��Σ��� KIO3 ��ʳ�Σ�1000kg���� KI �� Cl2 ��Ӧ֮ KIO3��������Ҫ���� Cl2_____mol������ 2 λС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��úȼ���ŷŵ���������NOx�������γ�������Ⱦ��������ͨ�����ֻ�ѧ�������������������������ش��������⣺
��1�������������£�������ӦΪ��6NO��g��+4NH3��g��5N2��g��+6H2O��g����H=-1807.0kJmol-1��T��ʱ���ں��ݵ��ܱ������У�����ڲ�ͬʱ��NO��NH3�����ʵ������±���
ʱ��/min | 0 | 1 | 2 | 3 | 4 |
n��NO��/mol | 1.20 | 0.90 | 0.72 | 0.60 | 0.60 |
n��NH3��/mol | 0.90 | 0.70 | 0.58 | 0.50 | 0.50 |
������˵����ȷ����______������ţ���
A��3min��NO��NH3��Ũ�ȶ����ٱ仯����Ӧֹͣ����
B��ǰ2min�ڵ�ƽ����Ӧ����v��N2��=0.20molL-1min-1
C���ﵽƽ��ʱNO��ת����Ϊ50%
D����ʱ�����N2����ʹ�÷�Ӧ�ķ�Ӧ��������ƽ�������ƶ�
������Ӧ��ʼ��ѹǿΪp0����÷�Ӧ�Ļ�ѧƽ�ⳣ��Kp=______�����÷�����ʾ����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
��2�������������£�NOxҲ�ܷ���������Ӧ��
����֪��N2��g��+O2��g��=2NO��g����H=180.6kJmol-1
N2��g��+3H2��g��2NH3��g����H=-92.4kJmol-1
H2O��g��=H2��g��+![]() O2��g����H=241.8kJmol-1
O2��g����H=241.8kJmol-1
��������Ӧ4NO��g��+4NH3��g��+O2��g��=4N2��g��+6H2O��g����H=______kJmol-1
�ڳ������������������������������ӦΪ2NO2��g��+O3��g��N2O5��g��+O2��g����H��0����Ӧ�ں����ܱ������н��У�NO2�İٷֺ�����ѹǿ��p����x�ı仯��ͼ��ʾ��
��p1______p2��������������������=������x��ʾ����������ʱ���⣬��������______��
��3�����ö��Ե缫���Ҳ�ܶ����������������������ԭ����ͼ��ʾ��

�缫a�ĵ缫��ӦʽΪ______�������44.8L����״������5%NO�������������ϵ�·��ͨ�����ӵ����ʵ���Ϊ______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCl2��һ�ֳ��õĻ�ԭ����ýȾ����ij��ѧС��ͬѧ��ʵ���������������ַ������Ʊ���ˮFeCl2���й����ʵ��������£�
C6H5Cl���ȱ��� | C6H4Cl2�����ȱ��� | FeCl3 | FeCl2 | |
�ܽ��� | ������ˮ�������ڱ����Ҵ� | ������C6H5Cl��C6H4Cl2�������������Ҵ�������ˮ | ||
�۵�/�� | -45 | 53 | ������ | |
�е�/�� | 132 | 173 | - | - |

��ش��������⣺
��1�����÷�Ӧ2FeCl3+C6H5Cl��2FeCl2+C6H4Cl2+HCl��ȡ��ˮFeCl2���ⶨFeCl3��ת���ʡ�����ͼװ�ã���������ƿ�з���32.5g��ˮ�Ȼ����������ȱ�����K1��K2���ر�K3��ͨһ��ʱ��H2��ر�K2������������ƿ�ڷ�Ӧ�¶���128-139�棬��Ӧһ��ʱ�䡣��Ӧ��ɺ��K2��ͨ����һ��ʱ�䡣
������a��������______��װ��B��ʢװ���Լ���______��
�ڷ�Ӧ����ͨ��H2��Ŀ����______��
����ȴʵ��װ�ã���������ƿ�����ʵ����������ˡ��ñ�ϴ�ӡ�����õ��ֲ�Ʒ��������Һ��C6H5Cl�IJ���������______��
�ܷ�Ӧ����ƿ����Һ���250mL��Һ��ȡ25.00mL������Һ����0.4molL-1NaOH��Һ�ζ�������NaOH��Һ23.60mL�����Ȼ�����ת����Ϊ______��
��2����K1��K3���ر�K2��ͨ�������Ȼ�����Ӧ��ȡ��ˮFeCl2��
��д����Ӧ�Ļ�ѧ����ʽ______��
��ʵ���Ƶ�FeCl2��ֹ�����IJ�����______��
����ָ�����Ʊ�������ȱ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� X��Y��Z ����Ԫ�أ���X��Y��Z �ĵ����ڳ����¾�Ϊ���壬��X ���ʿ����� Z �ĵ�����ȼ�գ��� �ɻ����� XZ������ʲ�ɫ����XZ ��������ˮ����ˮ��Һ�е��봦 X+�� Z������ˮ��Һ��ʹ��ɫʯ���� ֽ��죬��ÿ���� X2 ��������һ�� Y2���ӻ��ϳ����� X2Y ���ӣ�X2Y ������ΪҺ�壬��Z �������� X2Y �У����õ���Һ����Ư���ԡ�
��1��д���������ĵ���ʽ��X+_____��Z��______��Y ԭ��_____��
��2��д�� X2Y �Ļ�ѧʽ_____����Ҫ���� X2Y ���Ӿ�����ͬ�����������Ļ�ѧ���ţ�����ԭ�Ӻ� ��������_____��5 ��ԭ�Ӻ˵ķ���_____��
��3��д�� Z �������� X2Y �з�����Ӧ�����ӷ���ʽ��_____��������Һ��ʹ���۵� ������Һ��������Ҫ�����õ�����_____��
��4��ʵ�����Ʊ� XZ �Ļ�ѧ����ʽ��_____����μ��� XZ �Ƿ��ռ���__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������仯ʾ��ͼ������˵����ȷ���ǣ� ��

A. ״̬1��Һ̬����״̬3һ������̬
B. ״̬3��Һ̬����״̬4һ������̬
C. A��״̬2��+B��g���TC��״̬3��+D��g����H����d��a��kJmol��1
D. ����1molC��״̬3����1molD��g���еĻ�ѧ����Ҫ���յ�����Ϊ��e��d��kJ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com