


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
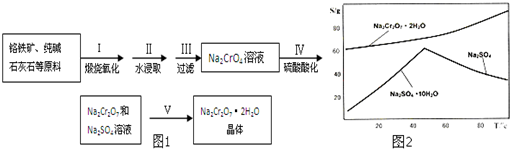
| ||
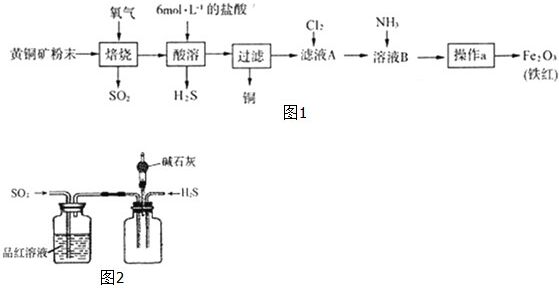
查看答案和解析>>
科目:高中化学 来源: 题型:
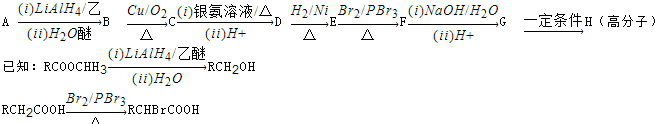
查看答案和解析>>
科目:高中化学 来源: 题型:

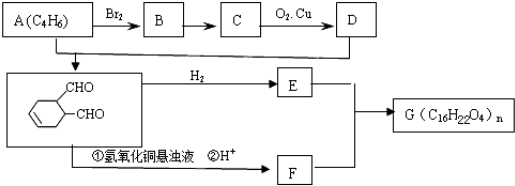
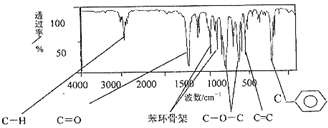
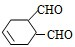 中含有的官能团的名称是
中含有的官能团的名称是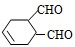 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:查看答案和解析>>
科目:高中化学 来源: 题型:
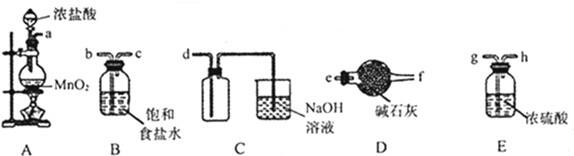
| A、SO2、Na2O2、活性炭都能使品红溶液褪色,但原理不同 |
| B、水在3.98℃时,主要以(H2O)2存在,这两个水分子间是以共价键相结合 |
| C、放热反应 的反应速率,不一定比吸热反应的反应速快 |
| D、同温同压下,3mol C2H4(g)和1mol CO(g)的密度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有① | B、只有③ |
| C、①④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
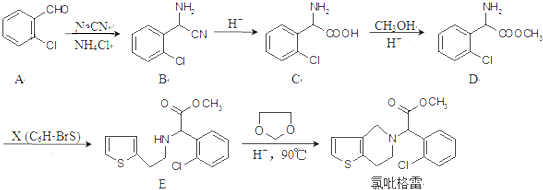
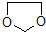 在酸性条件下生成氯吡格雷和另一种常见有机物,该有机物在浓硫酸催化下,加热脱水生成乙炔,试写出该有机物脱水生成乙炔的方程式
在酸性条件下生成氯吡格雷和另一种常见有机物,该有机物在浓硫酸催化下,加热脱水生成乙炔,试写出该有机物脱水生成乙炔的方程式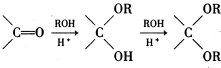
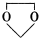 的合成路线流程图(无机试剂任选).合成路线流程示意图为:
的合成路线流程图(无机试剂任选).合成路线流程示意图为: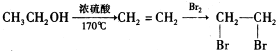
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com