
【题目】下列说法不正确的是 ( )
A.异丙苯(![]() )中所有碳原子不全在同一平面上
)中所有碳原子不全在同一平面上
B.乙烯与乙醇都能使酸性KMnO4溶液褪色
C.![]() 与
与![]() 互为同分异构体,且二氯代物均为6种
互为同分异构体,且二氯代物均为6种
D.苯的硝化和乙酸的酯化反应都是取代反应
【答案】C
【解析】
A.连接两个甲基的C原子采用sp3杂化,具有甲烷结构特点,所以该分子中所有C原子不能全部共平面,故A正确;
B.乙醇能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,含有碳碳不饱和键的有机物能被酸性高锰酸钾溶液氧化,乙烯中含有碳碳不饱和键,所以能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故B正确;
C.分子式相同、结构不同的有机物互为同分异构体,这两种物质的分子式都是C5H6,结构不同,所以属于同分异构体,但![]() 的二氯代物有6种,
的二氯代物有6种,![]() 二氯代物有5种,故C错误;
二氯代物有5种,故C错误;
D.有机物分子中的原子或原子团被其它原子或原子团所取代的反应为取代反应,苯的硝化反应是苯分子中的H原子被硝基取代,乙酸的酯化反应是乙酸中的羟基被其它原子团取代,所以二者都是取代反应,故D正确;
故答案为C。


科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,反应:A(s)+2B(g)![]() C(g) +D(g)。下列不能表明反应
C(g) +D(g)。下列不能表明反应
达到平衡状态的是( )。
A.气体的压强不变B.气体平均相对分子质量不变
C.气体的密度不变D.B物质的量浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺到2020年单位GDP二氧化碳排放比2005年下降40%~45%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:![]() ,测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
,测得CO2和CH3OH(g)的浓度随时间的变化如图所示。

(1)3~9min内,v(H2)=_________mol·L-1·min-1。
(2)能说明上述反应达到平衡状态的是________(填序号)。
A.反应中CO2与CH3OH的物质的量浓度之比为l:1(即图中交点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol CO2
D. CO2的体积分数在混合气体中保持不变
(3)平衡时CO2的转化率为________
(4)平衡时混合气体中CH3OH(g)的体积分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的pH判断或各微粒浓度关系,不正确的是( )
A.将![]() 的
的![]() 溶液与
溶液与![]() 溶液充分混合,若混合后溶液的体积为10mL,则混合液的
溶液充分混合,若混合后溶液的体积为10mL,则混合液的![]()
B.将![]() 的某一元酸HA溶液和
的某一元酸HA溶液和![]() 溶液等体积混合,混合液pH大于7,则反应后的混合液中:
溶液等体积混合,混合液pH大于7,则反应后的混合液中:![]()
C.pH相等的![]()
![]()
![]() 溶液中,
溶液中,![]() 大小关系:
大小关系:![]()
D.常温下,![]() 的
的![]() 和NaClO的混合溶液中:
和NaClO的混合溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g) ![]() 2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列说法正确的是( )
2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图展示了近代化学发展的几个重要里程碑。下列说法正确的是( )

A.1661年波义耳提出了元素的概念并发现了同位素
B.1774年拉瓦锡提出燃烧的氧化学说并揭示了氧化还原反应的本质
C.1803年道尔顿提出原子学说并揭示了原子构成的奥秘
D.1869年门捷列夫发现了元素周期律并制成了第一张元素周期表
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国用BeO、KBF4等原料制备KBe2BO3F2晶体,在世界上首次实现在177.3 nm深紫外激光倍频输出,其晶胞如图所示。下列说法错误的是( )
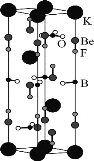
A. 构成晶体的非金属元素的电负性由大到小的顺序为F>O>B
B. KBF4中的阴离子的中心原子的杂化方式为sp2
C. 根据元素周期表中元素所处的位置可推测BeO与Al2O3性质相似
D. 晶胞中的K+有2个位于晶胞内部,8个位于晶胞顶点,则1mo1该晶胞含3molKBe2BO3F2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)一定条件下CO2可制得Na2CO3、NaHCO3等。
①等物质的量浓度的Na2CO3、NaHCO3溶液,碱性前者____后者(填“>”“<”或“=”)。
②有下列五种物质的量浓度均为0.1mol/L的电解质溶液,将其稀释相同倍数时,其中pH变化最大的是__(填字母编号)。
A.Na2CO3 |
B.NaHCO3 |
C.NaAlO2 |
D.CH3COONa |
E.NaOH
(2)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
该反应的平衡常数K随温度的变化如下:
温度(℃) | 300 | 500 | 700 |
K | 3.00 | 3.47 | 4.40 |
上述反应中a_______0(填“>”、“<”或“=”);在2L密闭容器中300℃下进行反应,若Fe和CO2的起始量均为4 mol,当达到平衡时CO2的转化率为________。
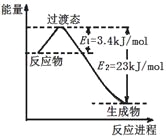
(3)目前工业上可以用CO2和H2在230℃、催化剂条件下反应生成甲醇蒸汽和水蒸气。下图为恒压容器中0.5 mol CO2和1.5 mol H2反应转化率达80%时的能量变化示意图。则该反应的热化学方程式为__________。
(4)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是制备HCOOH的示意图,根据要求回答问题:

①催化剂b表面的电极反应式为__________。
②经测定,若每分钟通过质子交换膜的H+的物质的量为40mol,则每小时可产生O2_____kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示。请回答:
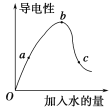
(1)醋酸的电离平衡常数表达式为:__________________________。
(2)a、b、c三点c(H+)由大到小的顺序是________________________________________。
(3)a、b、c三点中醋酸的电离程度最大的点是________点。
(4)若使c点溶液中的c(CH3COO-)提高,可采取的措施是________(填标号)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水 E.加固体CH3COONa F.加锌粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com