
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ①②③④ | D. | ①②③ |
分析 氢键属于分子间作用力一种,对物质的熔沸点、溶解性产生影响,对物质的化学性质无影响.
①ⅤA族中,N的非金属性最强,NH3中分子之间存在氢键;
②醇、羧酸与水分子之间能形成氢键;
③冰中存在氢键,其体积变大;
④尿素分子间可以形成多个氢键(2个N原子、1个O原子),醋酸分子间只有1个氢键(只有羟基可以形成氢键);
⑤HF分子之间能形成氢键;
⑥稳定性与化学键有关.
解答 解:①因第ⅤA族中,N的非金属性最强,NH3中分子之间存在氢键,则NH3的熔、沸点比VA族其他元素氢化物的高,故①正确;
②小分子的醇、羧酸与水分子之间能形成氢键,则可以和水以任意比互溶,故②正确;
③冰中存在氢键,其体积变大,则相同质量时冰的密度比液态水的密度小,故③正确;
④尿素分子间可以形成的氢键比醋酸分子间形成的氢键多,尿素的熔、沸点比醋酸的高,故④正确;
⑤HF分子之间能形成氢键,HF分子可缔合在一起,则液态氟化氢的化学式有时可以写成(HF)n的形式,故⑤正确;
⑥H2O比H2S稳定,其稳定性与化学键有关,而与氢键无关,故⑥错误;
故选:B.
点评 本题考查氢键及氢键对物质的性质的影响,明确氢键主要影响物质的物理性质是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 乙炔球棍模型: | B. | 质量数为的37的原子${\;}_{37}^{17}$Cl | ||
| C. | 氯化镁电子式: | D. | 氯离子的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钾溶于水时离子键未被破坏 | B. | 分子间作用力越大,分子越稳定 | ||
| C. | 冰融化时分子中共价键发生断裂 | D. | 原子晶体中共价键越强,熔点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
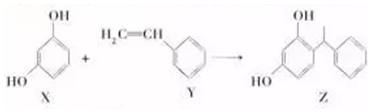
| A. | lmolX与溴水反应消耗3molBr2 | |
| B. | X能与Na2CO3溶液反应 | |
| C. | Y既能发生取代反应,也能发生加成反应 | |
| D. | 用酸性KMnO4溶液可鉴别X、Y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
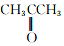
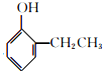 和
和 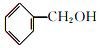
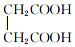 与
与 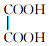
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一主族的元素从上到下金属性逐渐减弱 | |
| B. | 元素周期表是元素周期律的具体表现形式 | |
| C. | 同一周期从左到右,元素原子半径逐渐增大 | |
| D. | 非金属元素的最高正化合价等于它的负化合价的绝对值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
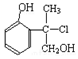 .下列叙述正确的是( )
.下列叙述正确的是( )| A. | 有机物A属于芳香烃 | |
| B. | 有机物A可以和Br2的CCl4溶液发生加成反应 | |
| C. | 有机物A和浓硫酸混合加热170℃时,可以发生消去反应 | |
| D. | 1mol A和足量的NaOH溶液反应,可以消耗2mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:推断题
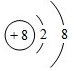 .
. ;含有离子键和共价键的化合物的化学式为Na2O2.
;含有离子键和共价键的化合物的化学式为Na2O2. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com