
【题目】某实验需要480mL 0.5mol/L的NaOH溶液,请回答下列问题:
(1)应称取NaOH的质量______g,应选用容量瓶的规格是_______mL。
(2)除容量瓶外还需要的其它玻璃仪器是________、________及玻璃棒
(3)配制时,其正确的操作顺序是(用字母表示,每个操作只能用一次)________。
A 将容量瓶盖紧,振荡,摇匀
B 用托盘天平准确称量所需的NaOH质量,倒入烧杯中,再加入适量水,用玻璃棒慢慢搅动,使其溶解(必要时可加热)
C 用适量水洗涤烧杯2-3次,洗涤液均注入容量瓶中,振荡
D 改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
E 将已冷却的溶液沿玻璃棒注入容量瓶中
F 继续往容量瓶内小心加水,直到液面接近刻度1-2cm 处
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)没有进行C操作________;配制溶液时,定容时仰视刻度线 ________;容量瓶未干燥________。
【答案】10.0 500 烧杯 胶头滴管 B、E、C、F、D、A 偏低 偏低 无影响
【解析】
(1)依据配制溶液体积选择容量瓶规格,依据m=cVM计算需要溶质的质量;依据配制一定物质的量浓度一般步骤选择需要仪器;
(2)根据实验步骤所需仪器解答;
(3)配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶贴标签,据此排序;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据![]() 进行误差分析。
进行误差分析。
(1)配制480mL 0.5mol/L的NaOH溶液,实验室没有480mL容量瓶,应选择500mL容量瓶,实际配制500mL溶液,需要溶质的质量= 0.5mol/L×40g/mol×0.5L= 10.0g;
故答案为:10.0, 500mL容量瓶;
(2)配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、500mL 容量瓶、胶头滴管,所以还需要的玻璃仪器:烧杯、胶头滴管;
故答案为:烧杯;胶头滴管;
(3)配配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,所以正确的顺序为:B、E、C、F、D、A;
故答案为:B、E、C、F、D、A;
(4)没有进行C操作导致溶质为完全转移到容量瓶,溶质的物质的量减少,根据![]() 可知,所配溶液浓度偏低;
可知,所配溶液浓度偏低;
配制溶液时,定容时仰视刻度线导致溶液体积偏小,,根据![]() 可知,所配溶液浓度偏低;
可知,所配溶液浓度偏低;
配制溶液时,洗涤后需要加入蒸馏水,所以容量瓶未干燥无影响;
故答案为:偏低;偏低;无影响。


科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B.向Na2SiO3溶液中通入过量的SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32-
C.由Na和C1形成离子键的过程:![]()
D.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向稀硝酸中加入少量铁粉,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
B | 将铜粉加入到1.0 mol·L-1 Fe2(SO4)3溶液中 | 铜粉溶解,溶液变蓝 | 金属铁比铜活泼 |
C | 将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合,达到平衡后再滴加4滴1 mol·L-1的KCl溶液 | 溶液红色加深 | 增大反应物浓度,平衡正向移动 |
D | 向10 mL 0.1 mol·L-1 AgNO3溶液中滴加4滴0.1 mol·L-1 NaCl溶液,然后再滴加4滴0.1 mol·L-1 Na2S溶液 | 先有白色沉淀生成,后有黑色沉淀生成 | 相同温度下,Ag2S的溶度积比AgCl的小 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保持街道整洁、湿润,在路面或广场上喷洒含化学式为XY2的溶液作保湿剂。X原子的结构示意图为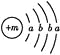 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m= ,该保湿剂的化学式为
(2)Z、W元素的名称为 、
(3)下列说法中正确的是
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是
A.XY2的电子式:X2+![]()
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-2Y-+Z↓
D.用电子式表示XY2的形成过程为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中所含微粒的个数比是1∶1的是( )
A. CH3COONa溶液中CH3COO-和Na+
B. NH4+中的质子和电子
C. Na2O2固体中阴、阳离子
D. ![]() 原子中的质子和中子
原子中的质子和中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.加入催化剂可以加快合成氨的速率
B.新制的氯水在光照条件下颜色变浅
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
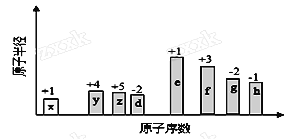
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的大小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴水(表面覆盖少量水)。请填写下列空白:
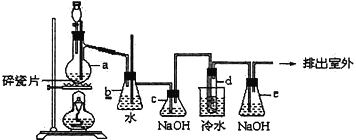
(1)图中碎瓷片的作用是_________________________,若在反应过程中发现未加碎瓷片,应该_____________________________。
(2)烧瓶a中温度计的作用是___________________,该反应是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速高到170℃,否则容易产生副反应。请你写出该副反应的反应方程式:_______________________________。
(3)写出制备1, 2-二溴乙烷的化学方程式:_______________________________。
(4)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:_______________________________。
(5)容器c中NaOH溶液的作用是:_______________________________。
(6)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因_________________________。
(7)e装置内NaOH溶液的作用是_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com