
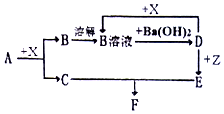
 下列物质均为常见物质或它们的溶液,其中A为淡黄色固休,C、X均为无色气体,Z为浅绿色溶液,D为一种常见的强碱.根据它们之间的转化关系(如图),用化学用语回答问题.(部分产物已省略)
下列物质均为常见物质或它们的溶液,其中A为淡黄色固休,C、X均为无色气体,Z为浅绿色溶液,D为一种常见的强碱.根据它们之间的转化关系(如图),用化学用语回答问题.(部分产物已省略) .
.分析 A为淡黄色固体化合物,X为无色气体,D为一种常见的强碱,并且X与D反应生成B溶液,所以X为酸性气体,B为盐,所以不难推出A是Na2O2,X为CO2,B为Na2CO3,C是O2,B与氢氧化钡生成D,则D为NaOH,Z为浅绿色溶液,说明含有亚铁离子,亚铁离子与NaOH溶液反应生成E为Fe(OH)2,Fe(OH)2与O2、水反应生F为Fe(OH)3,再结合题目分析解答.
解答 解:(1)通过以上分析知,A、B、D分别是Na2O2、Na2CO3、NaOH,故答案为:Na2O2;Na2CO3;NaOH;
(2)根据过氧化钠和二氧化碳的反应生成Na2CO3和O2,可以推知三氧化硫和过氧化钠反应生成硫酸钠和氧气,即2Na2O2+2SO3=2Na2SO4+O2,该反应中只有Na2O2中O元素的化合价发生变化,分别由-1价变化为0价和-2价,即转移电子数为2,用双线桥法表示电子转移方向和数目为 ,
,
故答案为: .
.
(3)Z为浅绿色溶液,说明含有亚铁离子,向Z溶液中通入一定量的Cl2,离子方程式为2Fe2++Cl2=2Fe3++2Cl-,则检验Z中Fe2+是否反应全所需试剂为K3Fe(CN)6,故答案为:K3Fe(CN)6;
(4)E为Fe(OH)2,Fe(OH)2与O2、水反应生F为Fe(OH)3,现象为白色沉淀转化为灰绿色沉淀,最终转化为红褐色沉淀,化学方程式为4Fe(OH)2+2H2O+O2=4Fe(OH)3,故答案为:白色沉淀转化为灰绿色沉淀,最终转化为红褐色沉淀;4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(5)D为NaOH,X为CO2,向含NaOH溶液中通入一定量的CO2后,完全反应后,在低温条件下蒸发结晶,最终得到14.8g固体;
①因为碳酸氢钠在温度过高时分解,所以蒸发结晶在低温条件下进行,故答案为:避免碳酸氢钠在温度过高时分解;
②氢氧化钠的物质的量为:$\frac{10g}{40g/mol}$=0.25mol,假设生成Na2CO3的物质的量为x,生成NaHCO3的物质的量为y,则根据钠原子守恒,2x+y=0.25,根据固体质量106x+84y=14.8,解得x=0.1,y=0.05,所以所得固体中含有的物质为Na2CO3和NaHCO3,它们的物质的量之比为n(Na2CO3):n(NaHCO3)=2:1,故答案为:Na2CO3和NaHCO3;n(Na2CO3):n(NaHCO3)=2:1.
点评 本题以Na、Fe元素及其化合物为载体考查了无机物推断,根据物质的颜色、物质之间的反应为突破口进行推断,熟悉常见元素化合物性质是解本题关键,会描述实验现象,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
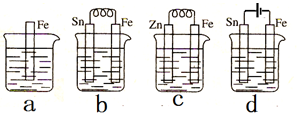
| A. | 装置b中Sn极附近溶液的pH将减小 | |
| B. | 装置c中用锌保护铁的方法称为牺牲阴极的阳极保护法 | |
| C. | 装置d中反应的离子方程式为Fe+2H+$\frac{\underline{\;电解\;}}{\;}$Fe2++H2↑ | |
| D. | 图a、b、c、d中纯铁被腐蚀的速率由快到慢的顺序是b>a>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 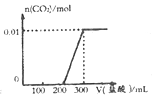 | ||
| C. |  | D. | 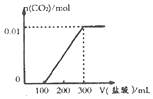 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
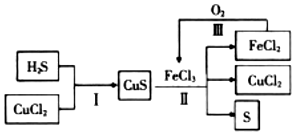
| A. | 在转化过程中化合价不变的元素只有Cu和Cl | |
| B. | 反应II中每生成1.25molS需要2.5molFeCl3 | |
| C. | 在转化过程中能循环利用的物质有FeCl2和CuCl2 | |
| D. | 反应Ⅲ中消耗1molO2时,可转化4mol的FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 5 | 15 | 25 | 35 | ||
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 | ||
| A. | 前 5 s 的平均反应速率v(A)=0.03 mol•L-1•s-1 | |
| B. | 正反应是吸热反应 | |
| C. | 保持温度不变,起始时向容器中充入2molC,达平衡时,C的转化率大于80% | |
| D. | 保持温度不变,起始时向容器中充入0.2molA、0.2molB?和1molC,反应达到平衡前v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的炭与水蒸气反应 | B. | Zn和稀H2SO4反应制氢气 | ||
| C. | Ba(OH)2•8H2O和NH4Cl反应 | D. | HCl溶液和NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入CCl4,CCl4层显紫色,说明原溶液中存在I- | |
| B. | 某溶液中滴加NaOH生成白色沉淀,迅速变成灰绿色,最终变成红褐色,则原溶液有Fe2+,无Fe3+ | |
| C. | 将CO2通入某溶液中,不能产生白色沉淀,说明原溶液中不含Ba2+或Ca2+ | |
| D. | 用干净的铂丝蘸取某溶液在酒精灯外焰上灼烧,火焰呈黄色,说明该溶液中有Na+无K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用氧化物形式表示为BaO•CuO•2SiO2 | |
| B. | 性质稳定,不易脱色 | |
| C. | 易溶解于强酸和强碱 | |
| D. | x等于6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
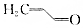 .则与键线式为
.则与键线式为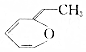 的物质互为同分异构体的是( )
的物质互为同分异构体的是( )| A. |  | B. |  | C. | 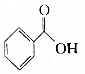 | D. | 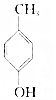 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com