
| A. | 产生H2量:X>Y | B. | 反应消耗镁的量:X>Y | ||
| C. | 反应起始时速率:X=Y | D. | 反应一段时间后速率:X>Y |
分析 一元强酸X溶液和一元弱酸Y溶液各10mL,c(H+)均为1×10-2mol/L,则所含酸的物质的量Y>X,足量金属镁反应产生氢气的物质的量Y>X,氢离子浓度相同,开始时反应速率X=Y,反应一段时间后X中氢离子浓度下降得快,Y中氢离子浓度下降得慢,反应速率X<Y,据此分析.
解答 解:A、足量金属镁反应产生氢气的物质的量Y>X,故A错误;
B、由于所含酸的物质的量Y>X,所以消耗Mg的量Y>X,故B错误;
C、c(H+)均为1×10-2mol/L,氢离子浓度相同,开始时反应速率X=Y,故C正确;
D、反应一段时间后X中氢离子浓度下降得快,Y中氢离子浓度下降得慢,反应速率X<Y,故D正确;
故选C.
点评 本题考查了影响反应速率的因素,注意相同c(H+)相同体积的一元强酸和弱酸所含酸的物质的量弱酸大于强酸,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用分液漏斗和容量瓶时,首先要查漏 | |
| B. | 蒸馏实验中,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体暴沸 | |
| C. | 向试管中加液体时,胶头滴管不能紧贴试管内壁 | |
| D. | 用蒸发皿进行加热蒸发时,一定要垫石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,2.24LCl2与足量水应,消耗1.8g H2O | |
| C. | 已知有N2(g)+3H2(g)?2NH3(g)△H=-92.0kJ•mol-1,如果该反应吸收的能量为46.0kJ,则形成N-H键的数目为3NA | |
| D. | 32g铜和足量硫完全反应,生成Cu2S,转移的电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①称量氢氧化钠固体 | B. | ②收集NO气体 | ||
| C. | ③配制100 mL 0.10 mol•L-1盐酸 | D. | ④吸收NH3不会造成倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融状态下的NaHSO4电离:NaHSO4═Na++H++SO42- | |
| B. | H2CO3的电离:H2CO3═2H++CO32- | |
| C. | 水溶液中的NaHCO3电离:NaHCO3═Na++HCO3- | |
| D. | 水溶液中的Fe(OH)3电离:Fe(OH)3═Fe3++3OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
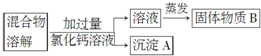
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com