
| N2的转化量 |
| N2的总量 |
| 2x |
| (1-x)+(3-3x)+2x |
| 6 |
| 28 |
| 1-x |
| 1-x+3-3x+2x |
| 3-3x |
| 1-x+3-3x+2x |
| x |
| 1 |


科目:高中化学 来源: 题型:
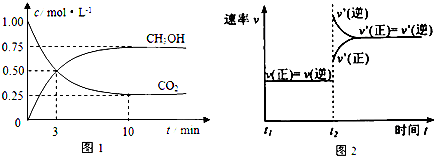
| 催化剂 |
| 加热、加压 |
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/mol?L-1 | 0.44 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀释溶液,水解程度减小 | ||||||
| B、通入CO2,平衡朝正反应方向移动 | ||||||
C、升高温度,
| ||||||
| D、加入NaOH固体,溶液PH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
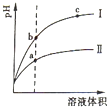 某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )| A、Ⅱ为盐酸稀释时pH变化曲线 |
| B、导电性:b点>c点 |
| C、Kw的数值:a点>c点 |
| D、酸的总浓度:b点>a点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、V3>V2=V1 |
| B、V3=V2=V1 |
| C、V3>V2>V1 |
| D、V1=V2>V3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2中阴阳离子的个数比为1:1 |
| B、Na2O2分别与H2O和CO2反应产生等质量的O2时,转移电子的物质的量相同 |
| C、Na2O2可与H2O反应生成碱,所以Na2O2为碱性氧化物 |
| D、Na2O2的漂白原理与SO2相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| B、某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| C、向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| D、将SO2通入品红溶液,溶液褪色后加热恢复原色,将SO2通入溴水,溴水褪色后加热也能恢复原色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
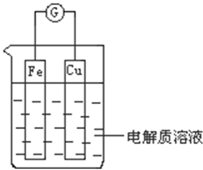 能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.
能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com