
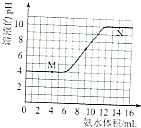
 常温下,用一定浓度的氨水滴定一定体积未知浓度的土壤浸出溶液,溶液的pH变化与滴入氨水体积的关系如图所示,下列有关说法不正确的是( )
常温下,用一定浓度的氨水滴定一定体积未知浓度的土壤浸出溶液,溶液的pH变化与滴入氨水体积的关系如图所示,下列有关说法不正确的是( )| A. | 该土壤是酸性土壤 | |
| B. | 当溶液中c(H+)=c(OH-)时,消耗氨水的体积为9mL | |
| C. | M、N点由水电离出的氢离子浓度一定相等 | |
| D. | 将20mL此氨水与10mL同浓度的盐酸混合,充分反应后存在:C(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+) |
分析 A.由图可知,该土壤浸出溶液pH=4;
B.当溶液中c(H+)=c(OH-)时,即pH=7,根据图可知消耗氨水的体积;
C.M点溶液酸性可能是离子水解导致,也可能是酸电离导致,N点氨水过量,N点溶液中氢离子源于水的电离;
D.将20mL此氨水与10mL同浓度的盐酸混合,得到等浓度的NH4Cl、NH3•H2O混合溶液,一水合氨的电离程度大于铵根离子水解程度,溶液呈碱性,但弱电解质电离程度不大.
解答 解:A.由图可知,该土壤浸出溶液pH=4,该土壤是酸性土壤,故A正确;
B.当溶液中c(H+)=c(OH-)时,即pH=7,根据图可知消耗氨水的体积为9mL,故B正确;
C.N点氨水过量,N点溶液中氢离子源于水的电离,M点溶液酸性可能是离子水解导致,也可能是酸电离导致,若为酸电离导致,M、N点由水电离出的氢离子浓度相等,若由离子水解导致,该情况下溶液中氢离子源于水的电离,M点由水电离出的氢离子浓度大于N点,故C错误;
D.将20mL此氨水与10mL同浓度的盐酸混合,得到等浓度的NH4Cl、NH3•H2O混合溶液,一水合氨的电离程度大于铵根离子水解程度,溶液呈碱性,但弱电解质电离程度不大.,溶液中c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+),故D正确.
故选:C.
点评 本题考查滴定曲线、离子浓度大小比较、盐类水解等,侧重考查学生读图获取信息能力、分析解决问题的能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 两种溶液中,水的电离程度:①>② | |
| B. | 分别中和等体积相同物质的量浓度的NaOH溶液,则消耗溶液的体积:①<② | |
| C. | 等体积的①、②溶液分别与足量铝粉反应,生成H2的质量:①=② | |
| D. | 将等体积的①、②溶液中分别稀释10倍后,溶液的pH:①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
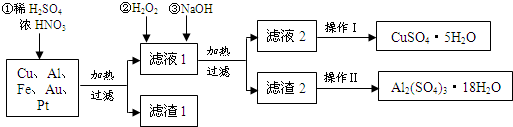

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
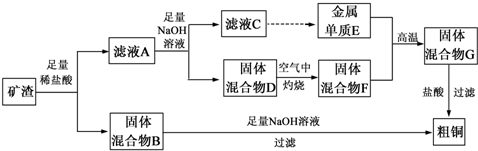
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
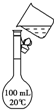 用18mol/L的浓硫酸配制150.00mL 1.00mol/L硫酸:
用18mol/L的浓硫酸配制150.00mL 1.00mol/L硫酸:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
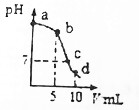 25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )
25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )| A. | a点时,CN-离子浓度大于其他点 | B. | b点时,c(HCN)>c(CN-) | ||
| C. | c点时,c(Na+)=c(Cl-)+c(CN-) | D. | d点时,溶液的c(H+)≈8×10-5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
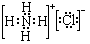 ;②B溶于水的过程中存在的可逆反应式为NH3+H2O
;②B溶于水的过程中存在的可逆反应式为NH3+H2O  NH3•H2O
NH3•H2O  NH4++OH-.
NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
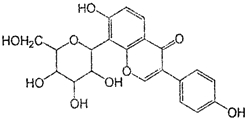
| A. | 该物质在一定条件下能发生消去反应、加成反应、取代反应 | |
| B. | 葛根素的分子式为C21H22O9 | |
| C. | 该物质在一定条件下能与碳酸氢钠溶液反应 | |
| D. | 一定条件下1 mol 该物质与H2反应最多能消耗7 mol H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com