
| a |
| 160 |
| a |
| 160 |
| 7a |
| 10 |
| ||||
| b |
| 7a |
| b |
| 7a |
| b |


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1000mL,212g | B.950mL,201.4g |
| C.500mL,286g | D.任意规格,572g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用蒸馏水润湿的pH试纸所测定的某酸溶液的pH |
| B.用容量瓶配制溶液,定容后摇匀液面下降,再加蒸馏水至刻度线所配制的溶液浓度 |
| C.用仰视量筒刻度量取的一定量浓硫酸所配制的0.1mol?L-1H2SO4溶液的浓度 |
| D.用待测液润洗的锥形瓶进行中和滴定所测定的待测液浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
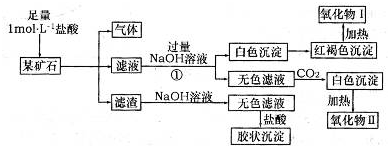
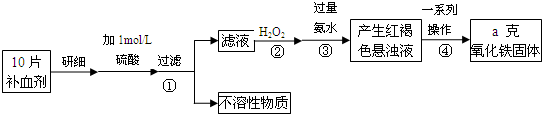
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.肯定含有NH4+、SO42-、Cl-,且c(SO42-)=0.1mol/L |
| B.可能含有Na+和Cl- |
| C.一定含有Na+,且c(Na+)≥0.1mol/L |
| D.一定不含CO32-和Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量粗盐于试管中,往试管中滴加过量稀盐酸,并用带导管的胶塞迅速塞住试管,导管的另一端通入澄清石灰水,观察现象, | (1)若能观察到试管中有气泡产生,产生的气体能使澄清石灰水变浑浊,则说明假设1或假设3成立;(2)若无明显现象则说明______成立. |
| 步骤2:继续往试管中滴加______,观察现象. | (1)若能观察到______结合步骤1中的(1)则说明______成立; (2)若无明显现象,结合步骤1中(1)则说明______成立. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
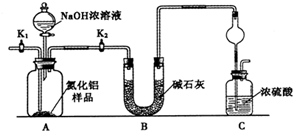
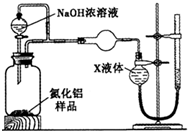
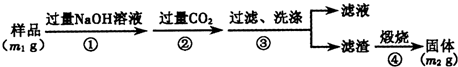
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com