
【题目】【化学——选修3:物质结构与性质】
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________(写出名称)。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:
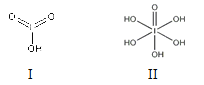
请比较二者酸性强弱:HIO3________H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(6)右图为碘晶体晶胞结构。有关说法中正确的是_________。
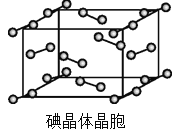
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
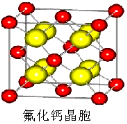
(7)已知CaF2晶体(见右图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
【答案】(1)P 4S24P5(2)氢键(3)碘(4)>(5)sp3 Cl2O(6)AD(7)a3ρNA/4
【解析】
试题分析:(1)卤族元素价电子排布式为ns2np5,位于元素周期表的p区;溴元素位于元素周期表的第四周期,第VIIA族,溴的价电子排布为4s24p5。
(2)氢氟酸分子间通过氢键缔合成(HF)2。
(3)由于碘的第一电离能在卤素原子中相对较小,最有可能生成较稳定的单核阳离子。
(4)HIO3的非羟基氧原子数较多,酸性强弱:HIO3>H5IO6。
(5)由于ClO2-的中心氯原子周围有四对价层电子,其中心氯原子的杂化轨道类型为sp3;根据“增减找邻、同族互换”的原则可确定ClO2-的等电子体为Cl2O或OF2。
(6)碘晶体晶胞结构属于面心立方晶胞,每个晶胞中含有8×1/8+6×1/2=4个碘分子,但碘原子数为8,B项错误;碘晶体属于分子晶体,C项错误,选AD。
(7)在CaF2晶胞中含有Ca2+:8×1/8+6×1/2=4个,含有F-:8个,相当于有4个CaF2,则ρ=4M/a3NA,化简得M=a3ρNA/4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)已知磷酸(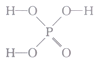 )分子中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2) 却不能与D2O发生氢交换。则H3PO2是(填“一元”“二元”或“三元”)酸,其分子的结构式为________(填字母)。
)分子中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2) 却不能与D2O发生氢交换。则H3PO2是(填“一元”“二元”或“三元”)酸,其分子的结构式为________(填字母)。

(2)H3PO2具有较强的还原性,可以通过电解的方法制备。“四室电渗析法”工作原理如图所示(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)。

①阳极的电极反应式为_________。
②II 膜为___________(填“阴离子交换膜”或“阳离子交换膜”)。
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的交换膜,从而合并阳极室与产品室,其缺点是产品中混有______杂质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是一种宝贵的碳氧资源。以CO2和NH3为原料合成尿素是固定和利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) △H1=a kJ·mol-1
NH2CO2NH4(s) △H1=a kJ·mol-1
反应Ⅱ:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
请回答下列问题:
(1)反应Ⅰ的△H1= (用具体数据表示)。
(2)反应Ⅱ的△S (填>或<)0,一般在 情况下有利于该反应的进行。
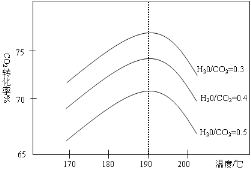
(3)反应Ⅲ中影响CO2平衡转化率的因素很多,下图1为某特定条件下,不同水碳比n(H2O)/n(CO2)和温度影响CO2平衡转化率变化的趋势曲线。
①其他条件相同时,为提高CO2的平衡转化率,生产中可以采取的措施是 (填提高或降低)水碳比。
②当温度高于190℃后,CO2平衡转化率出现如图所示的变化趋势,其原因是 。
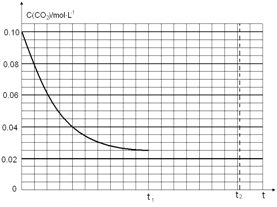
(4)某研究小组为探究反应Ⅰ中影响c(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如上图所示。若其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。
(5)尿素在土壤中会发生反应CO(NH2)2+2H2O![]() (NH4)2CO3。下列物质中与尿素有类似性质的是
(NH4)2CO3。下列物质中与尿素有类似性质的是
A.NH2COONH4 B.H2NOCCH2CH2CONH2
C.HOCH2CH2OH D.HOCH2CH2NH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.化学电池的反应基础是氧化还原反应
B.铅蓄电池是二次电池
C.燃料电池是一种高效,但是污染环境的发电装置
D.锌锰干电池是一次性电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只给出下列甲和乙中对应的物理量,不能求出物质的量的是( )
A | B | C | D | |
甲 | 物质中的粒子数 | 标准状况下的气体摩尔体积 | 固体的体积 | 溶液中溶质的物质的量浓度 |
乙 | 阿伏加德罗常数 | 标准状况下的气体的体积 | 固体的密度 | 溶液体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的过程如下:
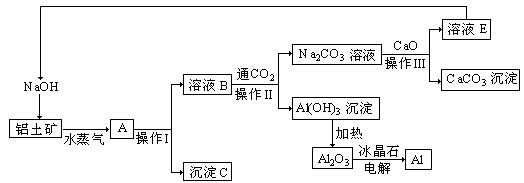
请回答下列问题:(1)水蒸气的作用 ;
(2)沉淀C的化学式为________,该物质除了用于金属冶炼以外,还可用作________;
(3)操作I、操作II、操作III都用到的玻璃仪器是有________________;
(4)写出制备过程中由溶液B生成Al(OH)3的离子方程式 ;
(5)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
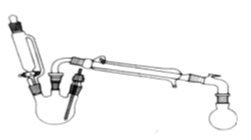
【题目】某研究性小组探究乙酸乙酯的反应机理,实验如下:
CH3COOH + C2H5OH ![]() CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
投料 1 : 1 CH3COOH转化率 65%
1 : 10 CH3COOH转化率 97%
(在120 ℃下测定)
已知:相关物理性质(常温常压)
密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
乙醇 | 0.79 | -114 | 78 | 溶 |
乙酸 | 1.049 | 16.2 | 117 | 溶 |
乙酸乙酯 | 0.902 | 84 | 76.5 | 不溶 |
合成反应:
在三颈瓶中加入乙醇5 mL,硫酸5 mL,2小片碎瓷片。漏斗加入乙酸14.3 mL ,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)酯化反应的机理
用乙醇羟基氧示踪
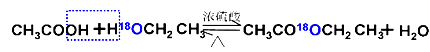
用醋酸羟基氧示踪

含氧18水占到总水量的一半,酯也一样。这个实验推翻了酯化反应为简单的取代反应。请你设想酯化反应的机理 。
2)酯化反应是一个可逆的反应,120 ℃时,平衡常数K= 。
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)浓硫酸与乙醇如何混合? 。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是? 。
(6)蒸出的粗乙酸乙酯中主要有哪些杂质? 。饱和的Na2CO3溶液洗涤除去乙酸。如何判断是否除净? 。用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,CuSO4在水中溶解度为25g,将32gCuSO4白色粉末加入到mg水中,形成饱和CuSO4溶液,并有CuSO4·5H2O晶体析出,则m的取值范围是
A. 18g≤m≤128g B. 36g<m<180g
C. 18g<m<128g D. 36g<m≤180g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com