
分析 (1)A、NaOH溶液与乙酸乙酯、乙酸都反应;
B、分馏石油时,温度计用于测量馏分的温度;
C、环己烷和水互不相溶;
D、氨水与银不反应;
E、配制银氨溶液应将稀氨水逐滴加到稀硝酸银溶液中;
F、氢氧化钠具有腐蚀性;
(2)N2H5Cl水溶液呈酸性,为强酸弱碱盐,若常温下将0.2mol/L HCl溶液与0.2mol/L N2H4•H2O溶液等体积混合(忽略混合后溶液体积的变化),二者恰好反应生成N2H5Cl,若测得混合溶液的pH=6,说明N2H5Cl水解,则促进水的电离,
若将0.2mol/L N2H4•H2O溶液与0.1mol/LHCl溶液等体积混合,所得溶液为N2H5Cl和N2H4•H2O的混合物,测得混合溶液的pH>7,则说明在相同条件下N2H4•H2O的电离程度大于N2H5Cl水解程度;
(3)①燃料电池中,电池的正极反应式为燃料电池的总反应减去负极反应式,电解质溶液中阴离子向负极移动;
②丁烷不完全氧化会生成碳粒,从而堵塞电极的气体通道
解答 解:(1)A、NaOH溶液与乙酸乙酯、乙酸都反应,应用饱和碳酸钠溶液除杂,故A错误;
B、分馏石油时,温度计用于测量馏分的温度,应位于蒸馏烧瓶的支管口附近,故B错误;
C、环己烷和水互不相溶,可用分液漏斗分离,故C正确;
D、氨水与银不反应,应用稀硝酸洗涤做过银镜反应的试管,故D错误;
E、配制银氨溶液时,将稀氨水逐滴加到稀硝酸银溶液中,至产生的沉淀刚好溶解时,恰好生成银氨溶液,故E正确;
F、氢氧化钠具有腐蚀性,不慎将苯酚溶液沾到皮肤上,立即用酒精溶液清洗,故F错误.
故答案为:CE;
(2)N2H5Cl水溶液呈酸性,为强酸弱碱盐,水解的离子方程式为N2H5++H2O?N2H4•H2O+H+,若常温下将0.2mol/L HCl溶液与0.2mol/L N2H4•H2O溶液等体积混合(忽略混合后溶液体积的变化),二者恰好反应生成N2H5Cl,若测得混合溶液的pH=6,说明N2H5Cl水解,则促进水的电离,
若将0.2mol/L N2H4•H2O溶液与0.1mol/LHCl溶液等体积混合,所得溶液为N2H5Cl和N2H4•H2O的混合物,测得混合溶液的pH>7,则说明在相同条件下N2H4•H2O的电离程度大于N2H5Cl水解程度,
故答案为:N2H5++H2O?N2H4•H2O+H+;>;>;
(3)①燃料电池的总反应和燃料燃烧的化学方程式一致,电池总反应为$\frac{2}{13}$C4H10+2O2--e-$\frac{8}{13}$CO2+$\frac{10}{13}$H20,O2在正极应该得到电子,总反应减负极反应可得正极反应式,为O2+4e-=2O2-;正极生成O2-,负极消耗O2-,O2-向负极移动,故答案为:负;
②烷不完全氧化会生成碳粒,从而堵塞电极的气体通道,故答案为:固体碳(或炭粒).
点评 本题考查较为综合,涉及化学实验方案的评价,盐类的水解以及原电池知识,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,注意相关基础知识的积累,难度中等.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 25℃时pH=10的NaOH溶液与pH=10的氨水中:c(Na+)>c(NH${\;}_{4}^{+}$) | |
| B. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) | |
| C. | 在NaHA溶液中(H2A为弱酸):c(Na+)>c(HA-)>c(OH-)>c(H+) | |
| D. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
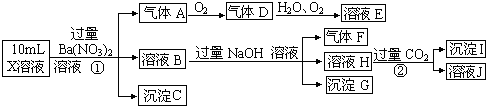
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
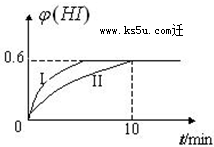 将1mol I2(g) 和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,2min时,测得I2的物质的量为0.6mol.10min后达到平衡,HI的体积分数φ(H)随时间变化如下图中曲线II所示.
将1mol I2(g) 和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,2min时,测得I2的物质的量为0.6mol.10min后达到平衡,HI的体积分数φ(H)随时间变化如下图中曲线II所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠用于治疗胃溃疡病人的胃酸过多症 | |
| B. | 在AlCl3溶液中加入过量氨水最终无沉淀生成 | |
| C. | 工业上可利用钠和TiCl4溶液反应制取金属Ti | |
| D. | 锅炉中水垢可用盐酸或醋酸除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:9 | B. | 1:49 | C. | 1:99 | D. | 以上都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
 ,B所含的阳离子的结构示意图是
,B所含的阳离子的结构示意图是 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com