
����Ŀ�����Ļ������������������й㷺���ڡ�
��1�������ǽ�1mol�����������AB��Ϊ������̬ԭ��A��B�������������֪���л�ѧ���ļ������±���

д��1mol��̬��(H2N-NH2)ȼ�����ɵ�����ˮ�������Ȼ�ѧ����ʽ________________��
��2���ý�̿��ԭNO�ķ�ӦΪ��2NO(g)+C(s)![]() N2(g)+CO2(g)�����ݻ���Ϊ1L�ļס��ҡ����������ݺ���(��Ӧ�¶ȷֱ�Ϊ400�桢400�桢T��)�����зֱ���������Ľ�̿��һ������NO����ø�������n(NO)�淴Ӧʱ��t�ı仯������±���ʾ��
N2(g)+CO2(g)�����ݻ���Ϊ1L�ļס��ҡ����������ݺ���(��Ӧ�¶ȷֱ�Ϊ400�桢400�桢T��)�����зֱ���������Ľ�̿��һ������NO����ø�������n(NO)�淴Ӧʱ��t�ı仯������±���ʾ��
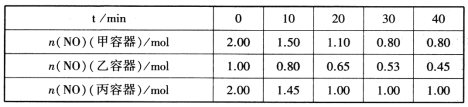
�ٸ÷�ӦΪ________(����ȡ������ȡ�)��Ӧ��
����������60minʱ�ﵽƽ��״̬����0��60min����NO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(NO)=____________��
��3���ý�̿��ԭNO2�ķ�ӦΪ��2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)���ں��������£�1molNO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
N2(g)+2CO2(g)���ں��������£�1molNO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
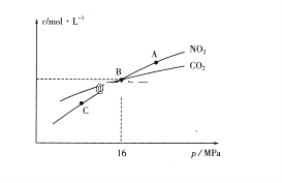
��A��C�����Ũ��ƽ�ⳣ����ϵ��Kc(A)________Kc(C)(�<����>����=��)��
��A��B��C������NO2��ת������ߵ���________(�A����B����C��)�㡣
���𰸡�2N2H4��g��+2NO2(g)=3N2(g)+4H2O(g),H=-544 KJ/mol ���� 0.01mol/(L��min) �� C
��������
��1�������ʱ�=��Ӧ���ܼ��ܣ��������ܼ��ܼ���1mol��̬��(H2N-NH2)ȼ�����ɵ�����ˮ�������ʱ䣻
��2�����Ƚϼס�����ͼ�����ݣ����ķ�Ӧ���ʴ��ڼף���֪�����¶ȴ���400����ƽ��ʱ����NOŨ�ȴ��ڼף����������¶�ƽ�������ƶ���
������v=c/t���㷴Ӧ���ʣ�
��3����A��C�����¶���ͬ������ƽ�ⳣ����ȣ�
������ѹǿƽ�������ƶ���
������ƽ�ⳣ������ʽ����B��ʱ�÷�Ӧ��ѹǿƽ�ⳣ����
��1�������ʱ�=��Ӧ���ܼ��ܣ��������ܼ��ܣ�1mol��̬��(H2N-NH2)ȼ�����ɵ�����ˮ�������ʱ�=193KJ/mol��391 KJ/mol��4��497 KJ/mol��946 KJ/mol��463 KJ/mol��4=��544 KJ/mol������1mol��̬��(H2N-NH2)ȼ�����ɵ�����ˮ�������Ȼ�ѧ����ʽ����2N2H4��g��+2NO2(g)=3N2(g)+4H2O(g),H=-544 KJ/mol��
����������������ǣ�2N2H4��g��+2NO2(g)=3N2(g)+4H2O(g),H=-544 KJ/mol��
��2�����Ƚϼס�����ͼ�����ݣ����ķ�Ӧ���ʴ��ڼף���֪�����¶ȴ���400����ƽ��ʱ����NOŨ�ȴ��ڼף����������¶�ƽ�������ƶ�����������Ӧ���ȣ�
�������������������������
�� 2NO(g)+C(s)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
��ʼ�� 2 0 0
�仯�� 1.2 0.6 0.6
ƽ���� 0.8 0.6 0.6
���������Ϊ1L�����Լ��з�Ӧ��ƽ�ⳣ��Ϊ=c(N2)��c(CO2)/ c2(NO)=0.6��0.6/0.8=4.5�������¶���ͬ������ƽ�ⳣ����ͬ������װ��NO��Ũ�ȱ仯��Ϊxmol/L��
2NO(g)+C(s)![]() N2(g)+CO2(g)��
N2(g)+CO2(g)��
��ʼ�� 1 0 0
�仯�� x 0.5x 0.5x
ƽ���� 1-x 0.5x 0.5x
���ԣ�0.5x��0.5x/(1-x)2=4.5�� x=0.6������v=c/t��v(NO)=0.6/60=0.01mol/(L��min)��
����������������ǣ�0.01mol/(L��min)��
��3����A��C�����¶���ͬ������ƽ�ⳣ����ȣ���Kc(A)=Kc(C)������������������ǣ�����
������ѹǿƽ�������ƶ���NO2��ת������ߵ���C������������������ǣ�C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�Ħ��������С����(����)
A. 10 mL H2O
B. 0.8 mol H2SO4
C. 54 g Al
D. 11.2LCO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.�Ȼ�����Һ�ڵ����������µ���������Ӻ�������
B.Cl2��ˮ��Һ�ܵ��磬��Cl2�Ƿǵ����
C.�����ܵ��磬�������ǵ����
D.���ᱵ������ˮ�������ᱵ�ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ͬ������,һ��ʢ��CO,��һ��ʢ��N2��C2H4,��ͬ��ͬѹ���������ڵ�����һ��������ͬ����.ԭ������ ��.�������� ��.�������� ��.����
A. �٢� B. �ڢ� C. �٢� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)����H����49.0 kJ��mol��1��һ�������£������Ϊ1 L�ĺ����ܱ������г���1 mol CO2��3 mol H2�����CO2��CH3OH(g)��Ũ����ʱ��仯������ͼ��ʾ��������������ȷ���� (����)
CH3OH(g)��H2O(g)����H����49.0 kJ��mol��1��һ�������£������Ϊ1 L�ĺ����ܱ������г���1 mol CO2��3 mol H2�����CO2��CH3OH(g)��Ũ����ʱ��仯������ͼ��ʾ��������������ȷ���� (����)

A. 3minʱ����CO2��Ũ�ȱ�ʾ������Ӧ���ʵ�����CH3OH��Ũ�ȱ�ʾ���淴Ӧ����
B. �ӷ�Ӧ��ʼ��ƽ�⣬H2��ƽ����Ӧ����v(H2)��0.225 mol��L��1��min��1
C. 13minʱ���������г���2 mol�������÷�Ӧ�Ļ�ѧ��Ӧ��������
D. 13minʱ���������г���2 mol������CO2��ת��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���-���������һ�����͵Ķ��ε�أ���ŵ�ʱ�Ĺ���ԭ����ͼ��ʾ������˵����ȷ����

A. �õ�طŵ�ʱ�������ķ�ӦʽΪO2��4e����4H��=2H2O
B. �õ�س��ʱ������������������Ӧ��Li����e��=Li
C. ����е��л����Һ������ϡ�������
D. ���ʱ����������ֱ����Դ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ��8NH3 + 3Cl2 = N2+ 6NH4Cl��Ӧ�У���������ԭ���뱻��ԭ��ԭ�ӵ����ʵ���֮��Ϊ
A��8��3 B��1��3 C��3��8 D��3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A��H��ת����ϵ����ͼ��ʾ������A��ֲ���������ڼ������IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ��D��һ�ֺϳɸ߷��Ӳ��ϣ����������������ʹ�����������ɫ��Ⱦ����G����NaHCO3��Һ��Ӧ�ų�CO2���塣
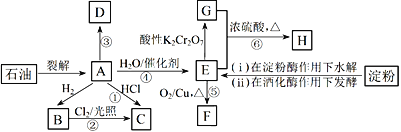
��ش��������⣺
(1)E�Ĺ���������Ϊ____________����Ӧ�۵ķ�Ӧ����__________________________��
(2)�����л���A��B��C��D������˵������ȷ����___________________(ѡ�����)��
a��B����ʹ��ˮ�����Ը��������Һ��ɫ����A��D����
b��B��ͬϵ���У���̼ԭ������5ʱ��ʼ����ͬ���칹����
c����������A��D��ȫȼ��ʱ����O2������ȣ�����CO2����Ҳ���
(3)д�����з�Ӧ�Ļ�ѧ����ʽ��
��Ӧ�ܣ�_________________________________��
��Ӧ�ݣ�_____________________________________��
(4)C��һ����Ч�ֲ��䶳�����������ɷ�Ӧ�ٻ���Ʊ�����ָ������һ����Ӧ�Ʊ��Ϻã�________����˵�����ɣ�____________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com