
| A. | 反应容器内压强不随时间变化 | |
| B. | P和S的生成速率相等 | |
| C. | 反应容器内P、Q、R、S四者物质的量浓度为1:1:1:1 | |
| D. | 反应容器内总物质的量不随时间而变化 |
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
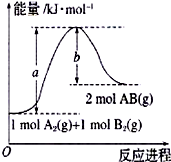 (1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.
(1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 通入过量的O2可以使SO2转化率达到100% | |
| C. | 升高温度可以增大反应速率 | |
| D. | 增大O2浓度可以增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多 | |
| B. | 氢气的燃烧热为285.5 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| C. | Ba(OH)2•8H2O(s)+2NH4Cl(s)═=BaCl2(s)+2NH3(g)+10H2O(l)△H<0 | |
| D. | 已知中和热为57.3 kJ/mol,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
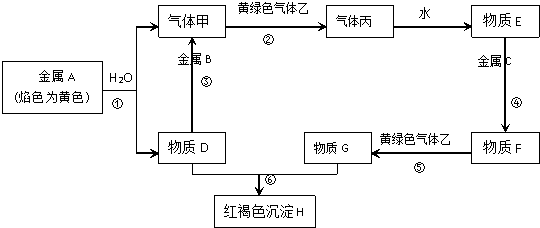
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
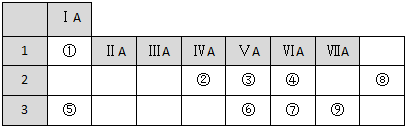
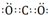 .
.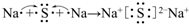 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | CO2通入苯酚钠溶液:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
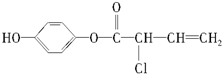 ,有关M的下列叙述中正确的是( )
,有关M的下列叙述中正确的是( )| A. | 可与H2反应,1 mol M最多消耗5 mol H2 | |
| B. | 可与浓溴水反应,1 mol M最多消耗4 mol Br2 | |
| C. | 可与NaOH溶液反应,1 mol M最多消耗4 mol NaOH | |
| D. | M不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
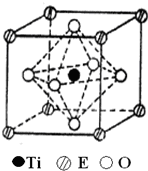 A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:| 元素 | 相关信息 |
| A | A的第一电离能低于同周期左右相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
| E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
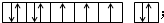 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com