
| NaHCO3��Һ BaCl2Ũ�� | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | ���� | ���� | �������� |
| 0.1mol•L-1 | ���� | �������� | ������ |
| 0.02mol•L-1 | �������� | ������ | ������ |
���� ��1��������̼��Ʒ�Ӧ���ɶ�����̼������Ȼ��ƣ����������ӷ���Ҫ��ȥ������̼�е��Ȼ��⣬�ݴ�ѡ��������
��2���ٱ��ͳ���ʯ��ˮ��̼���ƺ�̼�����ƾ��ܷ�Ӧ����̼��Ƴ������ݴ˽��
�ڼ����ʱ��Һ�б�����Ũ����̼���Ũ�ȵij˻�����¶���̼�ᱵ���ܶȻ������Ƚϼ��ɣ�
��ȡ��ʵ�����з���������Ʒ����pH�IJ���Ƚϼ��ɣ�
�ܷ���2NaHCO3 $\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2������ͼ���������ݿ�֪ʣ�����Ϊ6.3g�������������������������ͼ���֪�¶����߶�ʣ������������Ӱ�죮
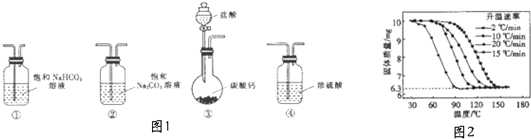
��� �⣺��1����Ϊ����װ�ã�������̼��Ʒ�Ӧ���ɶ�����̼������Ȼ��ƣ����������ӷ�����Ӧ��ѡȡ̼�����Ƴ�ȥ��������е�HCl������������˳��Ϊ���ۢ٢ڣ��ʴ�Ϊ���ۢ٢ڣ�
��2���ٱ��ͳ���ʯ��ˮ��̼���ƺ�̼�����ƾ��ܷ�Ӧ����̼��Ƴ������ʼ��������У��ʴ�Ϊ�������У�
�ڣ�i��������Һ�������Ϻ���Һ�б�����Ũ��=$\frac{0.2mol/L}{2}$=0.1mol/L��0.1 mol•L-1 NaHC03��Һ�������c��CO32-��Ϊ0.0011 mol•L-1����Q=Q=c��Ba2+����c��CO32-��=$\frac{0.2}{2}$��0.0011=1.1��10-4��5.1��10-9���ʻ����������
�ʴ�Ϊ��Q=c��Ba2+����c��CO32-��=$\frac{0.2}{2}$��0.0011=1.1��10-4��5.1��10-9��
��ii����������̼�����Ƶ������̼����������̼�ᱵ�������Ӷ��ٽ���̼������ĵ��룬ʹ��������̼����������ӵķ����ƶ��������ӷ�Ӧ����ʽΪ��Ba2++2HCO3-=BaCO3��+CO2��+H2O���ʴ�Ϊ��Ba2++2HCO3-=BaCO3��+CO2��+H2O��
�۱�����Ϊ�ⶨpH��������̼����������ǿ�������Σ�������ȷ�Ƚϸߵ�pH�ƽ�����Ʒ��pHֵ��Ȼ�����������NaHC03��pHֵ�����Ƚϼ��ɣ��ʴ�Ϊ��ȡ�������Ĺ�����Ʒ�ͷ�����NaHC03��Ʒ�ֱ��ܽ��ڵ�����ˮ�У��ֱ���pH�Ʋ�pH��
�ܣ�i��̼�����Ʋ��ȶ��������ֽ⣬����ʽΪ2NaHCO3 $\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2������
2NaHCO3 $\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2����
168 106
10g x����x=6.30g��
��������̼������ÿ��10g�ֽ�Ӧ����6.3g���壬����ͼ��֪10g��Ʒ�ֽ�ǡ�����ɹ���Ϊ6.3g���ʴ���Ʒ����Ϊ��$\frac{6.3g}{6.3g}$��100%=100%���ʴ�Ϊ��100%��
��ii����ͼ��֪���¶����ߣ���Ӱ��������ʵIJ������������ʶ�ʵ����û��Ӱ�죬�ʴ�Ϊ��û�У�
���� �����ۺϿ���������ʵ��Ʊ���������ƣ������IJⶨ���漰֪ʶ��϶࣬�ѶȽϴ���������̼�����Ƶ������Լ����ȷֽ�ԭ���ǽ������Ĺؼ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ۢ� | B�� | �٢ܢ� | C�� | �٢ڢ� | D�� | �ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ʒ����Һ | B�� | Ũ���� | C�� | ��ˮ��������Һ | D�� | ���϶��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ѻ��ǵ�Һ�嵹���������м��� | B�� | ��ʼ����������ò��������� | ||
| C�� | ��ˮ����ȫ���ɺ�ֹͣ���� | D�� | �������г��ֶ�������ʱֹͣ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �÷�Ӧ��40 min�ڵ�ƽ�����ʿɱ�ʾΪ �ͣ�NH3��=0.001 mol/L•min | |
| B�� | �÷�Ӧ�ﵽƽ��ʱ�����������������䣬������NH3��N2��H2�����ʵ���������� | |
| C�� | �����������䣬�����¶ȣ���ʹ�÷�Ӧ�����ʼӿ� | |
| D�� | �ﵽƽ��ʱ���ͣ�NH3��=�ͣ�N2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com