
| A. | 钠着火后,可用泡沫灭火器来灭火 | |
| B. | 氧化钠和过氧化钠都属于碱性氧化物 | |
| C. | 氧化钠和过氧化钠的组成元素相同,都可以与CO2反应且产物相同 | |
| D. | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 |
分析 A.钠燃烧生成过氧化钠,过氧化钠能和水、二氧化碳反应生成氧气,钠和水反应生成可燃性气体氢气;
B.和酸反应只生成盐和水的氧化物是碱性氧化物;
C.氧化钠和过氧化钠都能和二氧化碳反应生成碳酸钠,但过氧化钠和二氧化碳反应还生成氧气;
D.过氧化钠和二氧化碳、水反应是氧化还原反应是放热反应.
解答 解:A.钠燃烧生成过氧化钠,过氧化钠能和水、二氧化碳反应生成氧气,钠和水反应生成可燃性气体氢气,氧气具有助燃性、氢气具有可燃性,所以Na燃烧不能用泡沫灭火器来灭火,应该用沙土灭火,故A错误;
B.和酸反应只生成盐和水的氧化物是碱性氧化物,过氧化钠和酸反应除了生成盐外还生成氧气,所以过氧化钠不是碱性氧化物,故B错误;
C.氧化钠和过氧化钠都能和二氧化碳反应生成碳酸钠,但过氧化钠和二氧化碳反应还生成氧气,所以其产物不完全相同,故C错误;
D.CO2、H2O与Na2O2反应是放热反应,放出的热量达到脱脂棉的着火点,所以脱脂棉着火,故D正确;
故选D.
点评 本题考查钠及其化合物的性质,为高频考点,侧重考查学生对基础知识的掌握,明确元素化合物性质及基本概念内涵是解本题关键,注意:过氧化钠和酸反应还生成氧气,为易错点.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>cCH3COO-)>c(OH-) | |
| B. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:3(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2在正极发生还原反应 | B. | 供电时的总反应为2H2+O2═2H2O | ||
| C. | 燃料电池的能量转化率可达100% | D. | 氢氧燃料电池属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | A | B | C |
发 生 装 置 | 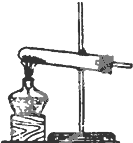 |  | 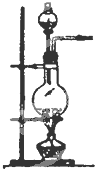 |
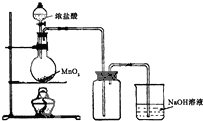
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 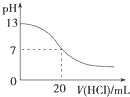 图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. |  图中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 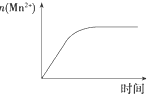 图表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 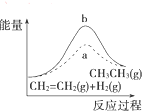 图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)-→CH3CH3(g)△H<0使用和未使用催 化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质与非电解质本质区别是在水溶液或熔化状态下能否电离 | |
| B. | 纯碱、烧碱均属于碱 | |
| C. | 电离时能产生H+的化合物,一定是酸 | |
| D. | 非金属氧化物一定是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g氧气和臭氧的混合物中含有的氧原子数为NA | |
| B. | 标准状况下,22.4 L水中含有的氧原子数为NA | |
| C. | 0.5mol•L-1的AlCl3溶液中所含Al3+数目为0.5NA | |
| D. | 0.1 mol 氦气所含有的原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “绿色食品”“白色污染”“赤潮”都不仅仅与颜色有关 | |
| B. | 苯酚皂溶液可用于环境消毒,医用酒精可用于皮肤消毒,其原因均在于可使蛋白质变性凝固 | |
| C. | “酸可以除锈”“洗涤剂可以去油”都是发生了化学变化 | |
| D. | 区分植物油和矿物油的方法是加入足量的烧碱溶液共煮,不再分层的为植物油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com