
(本题共12分)铜是生命必需的元素,也是人类广泛使用的金属。
28.现代工业上,主要采用高温冶炼黄铜矿(CuFeS2,也可表示为Cu2S?Fe2S3)的方法获得铜。火法炼铜首先要焙烧黄铜矿:2CuFeS2+4O2 Cu2S+3SO2+2FeO,反应中被还原的元素有 ,每转移0.6mol电子,有 mol硫被氧化。产物中的SO2是一种大气污染物,可选用下列试剂中的 吸收(选填编号)。
Cu2S+3SO2+2FeO,反应中被还原的元素有 ,每转移0.6mol电子,有 mol硫被氧化。产物中的SO2是一种大气污染物,可选用下列试剂中的 吸收(选填编号)。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.CaCl2
29.Cu2O投入足量的某浓度的硝酸中,若所得气体产物为NO和NO2的混合物,且体积比为1﹕1,发生反应的化学方程式为: 。
30.某同学通过电化学原理实现了如下转化:Cu+2H+→Cu2++H2↑,则H2在 极获得(填写电极名称)。
31.向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式 。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释 。
32.将SO2气体通入CuCl2溶液中,生成CuCl沉淀的同时,还有产物 (填写化学式)。
28、CuFeS2中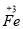 元素、O2中
元素、O2中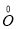 元素(1x2分) 0.1(1分) c(1分)
元素(1x2分) 0.1(1分) c(1分)
29、2Cu2O + 10HNO3 → 4Cu(NO3)2 + NO↑ +NO2↑ + 5H2O(1分× 2) 30、阴 (1分)
31、Fe(OH)3 (1分) Fe3+会水解产生较多的H+:Fe3++ 3H2O Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀。(2分)
Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀。(2分)
32、H2SO4 HCl(1分×2)
【解析】
试题分析:28、CuFeS2,也可表示为Cu2S?Fe2S3,这说明Cu的化合价是+1价,铁是+3价。根据方程式可知S元素的化合价从-2价升高到+4价,铁元素的化合价从+3价降低+2价,氧元素的化合价从0价降低到-2价,所以反应中被还原的元素有Fe和O。S元素化合价升高到6价,因此每转移0.6mol电子,有0.1mol硫被氧化。SO2是酸性氧化物能被氢氧化钠吸收,浓硫酸和氯化钙与SO2不反应。硝酸吸收SO2的同时生成NO2等污染性气体,所以答案选c。
29、Cu2O投入足量的某浓度的硝酸中发生氧化还原反应生成硝酸铜、水和氮氧化合物,若所得气体产物为NO和NO2的混合物,且体积比为1﹕1,则发生反应的化学方程式为2Cu2O + 10HNO3 → 4Cu(NO3)2 + NO↑+NO2↑+ 5H2O。
30、根据方程式Cu+2H+→Cu2++H2↑可知氢气是还原产物。该反应需要通过电解原理实现。电解池中阳极失去电子生成氧化产物,阴极得到电子得到还原产物,所以H2在阴极获得。
31、氯化铁是强酸弱碱盐,在溶液中Fe3+会水解产生较多的H+,离子方程式为Fe3++ 3H2O Fe(OH)3+3H+,加入CuO能与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,从而生成Fe(OH)3沉淀。
Fe(OH)3+3H+,加入CuO能与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,从而生成Fe(OH)3沉淀。
32、将SO2气体通入CuCl2溶液中,生成CuCl沉淀,这说明氯化铜是氧化剂,则SO2是还原剂,氧化产物是硫酸根,所以根据原子守恒可知还有产物是硫酸和盐酸。
考点:考查氧化还原反应的应用


科目:高中化学 来源:2014-2015学年浙江省高三1月份阶段测试化学试卷(解析版) 题型:选择题
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,Y与M形成的气态化合物在标况下的密度为0.76g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.由X、Y、Z、M四种元素形成的化合物一定有共价键
B.原子半径:W>Z>Y>X>M
C.由X元素形成的单质一定是原子晶体
D.XZ2、X2M2、W2Z2均为直线型的共价化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:填空题
(本题共12分)氯化钙是典型的离子型卤化物。完成下列填空:
28.氯原子核外电子排布式为 ,其原子核外能量不同的电子有 种,最外层上有 种不同运动状态的电子,钙元素在元素周期表中位于 。
某研究小组以CaCl2和H2为原料,试图制备+1价Ca的化合物,结果发现产物中只有两种化合物甲和乙。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.29%、46.41%;已知甲与水反应可得H2,乙的水溶液显酸性。
29.该研究小组是否成功制得了+1价Ca的化合物? (填“是”或“否”)。甲的化学式是 。
30.写出甲与水反应得H2的化学方程式 。现欲检验该反应所得溶液中是否含有Cl-,请简述检验的方法 。
31.乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
欲证明一瓶无色液体是纯水,可靠的实验方法是
A.测得其pH=7 B.电解时得到H2与O2的体积比为2:1
C.遇钠生成氢气 D.1.01× 105Pa时沸点为100℃
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:计算题
(本题共14分)自然界中,金属硫化物矿床常因发生表生氧化及次生富集作用,产生辉铜矿(Cu2S)与铜蓝(CuS)。
已知:Cu2S、CuS是两种不溶于水的黑色固体,在一定条件下都能与稀HNO3反应:
①3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O
现将四份质量不同的某Cu2S和CuS混合物样品分别与100mL 5mol/L的稀硝酸充分反应,样品质量与产生气体的体积(已折合成标准状况)如下表所示:
实验编号 | 甲 | 乙 | 丙 |
样品质量(g) | 9.6 | 12.8 | 64.0 |
气体体积(L) | 5.04 | 6.72 | V |
试回答下列问题(不考虑硝酸的挥发以及溶液体积变化):
53.用质量分数为0.63、密度为1.42g/cm3的浓硝酸配置100mL、5mol/L的稀硝酸,需浓硝酸的体积为 。(保留1位小数)
54.甲实验结束后,溶液中c(NO3-) = 。
55.混合物样品中Cu2S、CuS的物质的量之比是多少?(写出计算过程)
56.乙实验结束后,溶液中氢离子的浓度是多少?(写出计算过程)
57.计算丙实验中产生气体的体积(V)。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:选择题
如图:甲为直流电源,乙为用含有酚酞的饱和食盐水浸透的滤纸,丙为电镀槽。断开K后,发现乙上c点附近显红色;闭合K,可实现铁上镀锌,电路中通过0.002NA个电子。以下判断正确的是
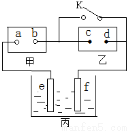
A.a为正极
B.d上发生还原反应
C.e为锌板
D.f的质量增加0.056 g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:选择题
实验室制取氯气并回收氯化锰,能达到该实验目的的装置是

A.用装置甲制取氯气 B.用装置丙分离二氧化锰和氯化锰溶液
C.用装置乙吸收制取氯气的尾气 D.用装置丁蒸干氯化锰溶液制 MnCl2·4H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市嘉定区高三一模化学试卷(解析版) 题型:填空题
常温下有五种溶液:①NaHCO3 ;②KNO3;③ NH4HCO3;④ KOH;⑤ HCl
28.上述五种溶液中既能跟盐酸反应又能跟NaOH溶液反应的是 (填序号)。
上述①的水溶液呈碱性的原因是(用离子方程式表示) 。
29.取10mL 0.5mol/L⑤的溶液加水稀释到500mL,则该溶液中由水电离出的c(H+)= mol/L.  ③跟足量的NaOH浓溶液在加热条件下反应的离子方程式是
③跟足量的NaOH浓溶液在加热条件下反应的离子方程式是
30.②和④混合后撒入铝粉,有气体产生,该气体能使湿润的红色石蕊试纸变蓝。
写出该反应化学方程式:_______________________________________________________。
31.最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:
2N2 (g)+6H2O (l) 4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变小,该反应 (选填编号)。 A.一定向正反应方向移动
4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变小,该反应 (选填编号)。 A.一定向正反应方向移动
B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动
D.在平衡移动时逆反应速率先减小后增大
32.如果上述反应在体积不变的密闭容器中进行,当反应达到平衡后,下列判断错误的是
A.容器中气体的平均分子量不随时间而变化
B.通入大量稀有气体能提高反应的速率
C.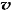 (N2)/
(N2)/  (O2)=2:3
(O2)=2:3
D.容器中气体的密度不随时间而变化
33.若反应的容器容积为2.0L,反应时间4.0 min,容器内气体的密度增大了0.18 g/L,在这段时间内O2的平均反应速率为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:选择题
钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为W(s) + 2I2(g) WI4(g)。下列说法正确的是
WI4(g)。下列说法正确的是
A.温度越高,灯丝的使用寿命越长
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com