
| 水解 |
| 乳酸菌 |

 ,乳酸在一定条件下发生反应得到聚乳酸的化学方程式是:n
,乳酸在一定条件下发生反应得到聚乳酸的化学方程式是:n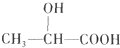
| 一定条件 |
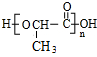 +(n-1)H2O,
+(n-1)H2O, ;n
;n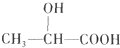
| 一定条件 |
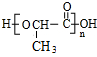 +(n-1)H2O.
+(n-1)H2O.


科目:高中化学 来源: 题型:
| A、①②④⑥⑧ |
| B、①②⑤⑥⑦ |
| C、②③④⑥⑧ |
| D、③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
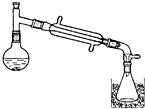 一溴乙烷为无色液体,熔点-119.1℃,沸点38.4℃,常用于汽油的乙基化、冷冻剂和麻醉剂.制备一溴乙烷的反应原理为:NaBr+H2SO4═HBr↑+NaHSO4,CH3CH2OH+HBr→CH3CH2Br+H2O.实验室可用如图装置制备一溴乙烷
一溴乙烷为无色液体,熔点-119.1℃,沸点38.4℃,常用于汽油的乙基化、冷冻剂和麻醉剂.制备一溴乙烷的反应原理为:NaBr+H2SO4═HBr↑+NaHSO4,CH3CH2OH+HBr→CH3CH2Br+H2O.实验室可用如图装置制备一溴乙烷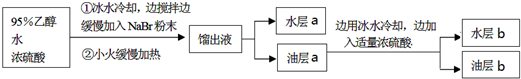
| 实验步骤 | 预期现象和结论 |
| 步骤1:将油层b转移至 | |
| 步骤2:取步骤1的水层少量于试管中,加入稀硫酸酸化,再加入适量新制氯水及少量CCl4,充分振荡,静置. | 溶液分层,下层呈橙红色,证明 |
| 步骤3:将步骤1的油层充分洗涤、干燥后装入蒸馏装置中, | 馏出蒸汽的温度稳定在38℃左右,不再有蒸汽馏出时,将蒸馏烧瓶中残留液体置于冰水浴中冷却,凝结成白色固体,则证明油层b中含有1,2-二溴乙烷. |
查看答案和解析>>
科目:高中化学 来源: 题型:
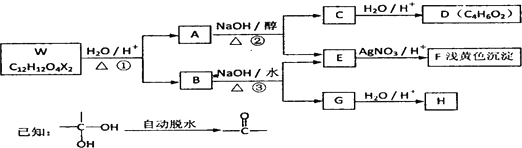
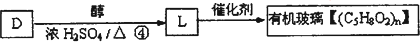
查看答案和解析>>
科目:高中化学 来源: 题型:
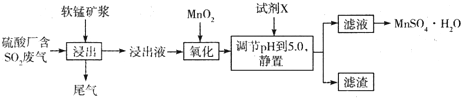
| 离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
| 开始沉淀时pH | 7.6 | 2.7 | 3.8 | 8.3 |
| 完全沉淀时pH | 9.7 | 4.0 | 4.7 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
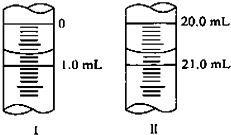 在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO
在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO- 4 |
2- 4 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com