
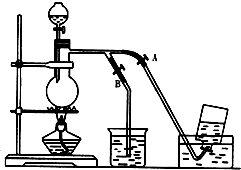
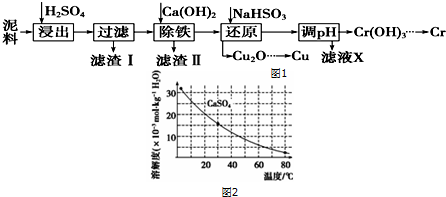
·ÖĪö £Ø1£©ŹµŃéŹŅÓĆ¼ÓČȶžŃõ»ÆĆĢÓėÅØŃĪĖį»ģŗĻĪļÖʱøĀČĘų£»
£Ø2£©ŅĄ¾ŻĀČĘųÓŠ¶¾£¬Ö±½ÓÅÅ·ÅÄÜŅżĘšæÕĘųĪŪČ¾£¬ĀČĘųÄܹ»ÓėĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĀČ»ÆÄĘ”¢“ĪĀČĖįÄĘĖ®£¬æÉŅŌÓĆĒāŃõ»ÆÄĘĪüŹÕ¹żĮæµÄĀČĘų£»
£Ø3£©ŅĄ¾ŻĀČĘųŌŚ±„ŗĶŹ³ŃĪĖ®ÖŠČܽā¶Č²»“ó½ā“š£»
£Ø4£©æŖŹ¼ŹÕ¼ÆĀČĘųŹ±£¬Ó¦¹Ų±ÕB“ņæŖAÓĆÅÅŅŗ·ØŹÕ¼Æ£»
ĀČĘųŹÕ¼ÆĶź±Ļ£¬¹żĮæµÄĀČĘųÓ¦ÓĆŹ¢ÓŠĒāŃõ»ÆÄʵÄÉÕ±ĪüŹÕ£¬ĖłŅŌÓ¦“ņæŖB¹Ų±ÕA£®
½ā“š ½ā£ŗ£Ø1£©¶žŃõ»ÆĆĢÓėÅØŃĪĖįŌŚ¼ÓČČĢõ¼žĻĀ·“Ӧɜ³ÉĀČĘų”¢ĀČ»ÆĆĢŗĶĖ®£¬·½³ĢŹ½£ŗMnO2+4HCl£ØÅØ£© $\frac{\underline{\;\;”÷\;\;}}{\;}$ MnCl2+Cl2”ü+2H2O£»
¹Ź“š°øĪŖ£ŗMnO2+4HCl£ØÅØ£© $\frac{\underline{\;\;”÷\;\;}}{\;}$ MnCl2+Cl2”ü+2H2O£»
£Ø2£©ĀČĘųÓŠ¶¾£¬Ö±½ÓÅÅ·ÅÄÜŅżĘšæÕĘųĪŪČ¾£¬ĀČĘųÄܹ»ÓėĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĀČ»ÆÄĘ”¢“ĪĀČĖįÄĘĖ®£¬Ąė×Ó·½³ĢŹ½£ŗCl2+2OH-=Cl-+ClO-+H2O
£¬ĖłŅŌæÉŅŌÓĆĒāŃõ»ÆÄĘČÜŅŗĪüŹÕ¹żĮæµÄĀČĘų£»
¹Ź“š°øĪŖ£ŗĒāŃõ»ÆÄĘČÜŅŗ£»ĪüŹÕ¶ąÓąµÄĀČĘų£»Cl2+2OH-=Cl-+ClO-+H2O£»
£Ø3£©Ķ¼ÖŠŹÕ¼ÆĀČĘų·½·ØĪŖÅÅŅŗ·ØŹÕ¼Æ£¬ĖµĆ÷ĀČĘųŌŚøĆŅŗĢåÖŠČܽā¶Č²»“󣬶ųĀČĘųŌŚ±„ŗĶŹ³ŃĪĖ®ÖŠČܽā¶ČŗÜÉŁ£¬ĖłŅŌæÉŅŌÓĆÅű„ŗĶŹ³ŃĪĖ®·½·ØŹÕ¼Æ£»
¹Ź“š°øĪŖ£ŗ±„ŗĶŹ³ŃĪĖ®£»
£Ø4£©æŖŹ¼ŹÕ¼ÆĀČĘųŹ±£¬Ó¦¹Ų±ÕB“ņæŖAÓĆÅÅŅŗ·ØŹÕ¼Æ£»ĀČĘųŹÕ¼ÆĶź±Ļ£¬¹żĮæµÄĀČĘųÓ¦ÓĆŹ¢ÓŠĒāŃõ»ÆÄʵÄÉÕ±ĪüŹÕ£¬ĖłŅŌÓ¦“ņæŖB¹Ų±ÕA£»
¹Ź“š°øĪŖ£ŗ¢Ł“ņæŖA£¬¹Ų±ÕB£»
¢Ś“ņæŖB£¬¹Ų±ÕA£®
µćĘĄ ±¾Ģāæ¼²éĮĖĀČĘųµÄŹµŃéŹŅÖʱø£¬Ć÷Č·ĀČĘųÖʱøŌĄķµÄŠŌÖŹŹĒ½āĢā¹Ų¼ü£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.04mol•L-1 | B£® | 0.04mol•L-1•s-1 | C£® | 0.08mol•L-1 | D£® | 0.08mol•L-1•s-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ń”Ļī | ŅŖ¼ų±šµÄĪļÖŹ×é | ŹŌ¼Į | ·½·Ø |
| A | NaCl/Na2CO3 | BaCl2ČÜŅŗ | ¹Ū²ģŹĒ·ń²śÉś³Įµķ |
| B | NO2/Br2 | ŹŖČóµÄµķ·Ūµā»Æ¼ŲŹŌÖ½ | ¹Ū²ģŹŌÖ½ŹĒ·ń±äĄ¶É« |
| C | ŅŅ“¼/ŅŅĖį | ŠĀÖĘĒāŃõ»ÆĶŠü×ĒŅŗ | ¹Ū²ģČÜŅŗŹĒ·ń±ä³ĪĒå |
| D | CO2/SO2 | Ę·ŗģČÜŅŗ | ¹Ū²ģČÜŅŗŗģÉ«ŹĒ·ńĶĖČ„ |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
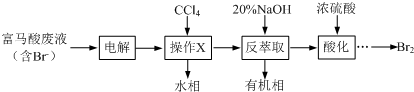
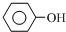 +3Br2”ś
+3Br2”ś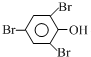 ”ż+3HBr
”ż+3HBr²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | C-£¾D2-£¾A+£¾B2+ | B£® | B2+£¾A+£¾C-£¾D2- | C£® | B2+£¾A+£¾D2-£¾C- | D£® | D2-£¾C-£¾A+£¾B2+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | H2OÓėH2O2 | B£® | ${\;}_{6}^{12}C$Óė${\;}_{6}^{14}C$ | ||
| C£® | ŹÆÄ«Óė½šøÕŹÆ | D£® | Õż¶”ĶéÓėŅģ¶”Ķé | ||
| E£® | £® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ĪļÖŹ | Fe3+ | Cu2+ | Cr3+ |
| æŖŹ¼³ĮµķpH | 2.1 | 4.7 | 4.3 |
| ĶźČ«³ĮµķpH | 3.2 | 6.7 | a |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 12.5g | B£® | 13.2g | C£® | 19.7g | D£® | 24.4g |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŖĖŲX µÄ¼ņµ„ĘųĢ¬Ēā»ÆĪļµÄČČĪČ¶ØŠŌ±ČW µÄČõ | |
| B£® | Ō×Ó°ė¾¶µÄ“óŠ”Ė³Šņ£ŗrY£¾rZ£¾rW£¾rX | |
| C£® | »ÆŗĻĪļYX”¢ZX2”¢WX3 ÖŠ»Æѧ¼üµÄĄąŠĶĻąĶ¬ | |
| D£® | ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄĖįŠŌ£ŗW±ČZ µÄČõ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com