选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g)+2B(g)?4C(g)△H>0达到平衡时,c(A)=2mol?L
-1,c(B)=7mol?L
-1,c(C)=4mol?L
-1.试确定B的起始浓度c(B)的取值范围是
;
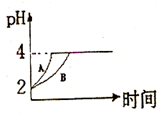
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是
( 填“A”或“B”).设盐酸中加入的Zn质量为m
1,醋酸溶液中加入的Zn质量为m
2. 则m
1
m
2( 选填“<”、“=”、“>”).
(3)在体积为3L的密闭容器中,CO与H
2在一定条件下反应生成甲醇:CO(g)+2H
2(g)=CH
3OH(g)△H=-91kJ?mol
-1.反应达到平衡时,平衡常数表达式K=
,升高温度,K值
(填“增大”、“减小”或“不变”).
(4)难溶电解质在水溶液中也存在溶解平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:Cu(OH)
2(s)?Cu
2+(aq)+2OH
-(aq),Ksp=c(Cu
2+)c
2(OH
-)=2×10
-20.当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀.若某CuSO
4溶液里c(Cu
2+)=0.02mol?L
-1,如果生成Cu(OH)
2沉淀,应调整溶液pH,使pH大于
.

 选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:

 试用Zn+2H+═Zn2++H2↑的反应设计原电池.
试用Zn+2H+═Zn2++H2↑的反应设计原电池.