
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解(如铵盐和强碱).
解答 解:吸热过程或放热过程与吸热反应或放热反应不同:
①水汽化是物理变化,不属于吸热反应.
②CuSO4•5H2O受热分解生成CuSO4和H2O,属于吸热反应;
③苛性钠固体溶于水是放热过程,属于物理变化,故③错误;
④氯酸钾分解制氧气属于吸热反应,故④正确;
⑤生石灰跟水反应生成熟石灰是化合反应,属于放热反应,故⑤错误;
⑥干冰升华为物理变化,故⑥错误;
故答案为:②④.
点评 本题考查化学反应的热量变化,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题,题目较简单.


科目:高中化学 来源: 题型:多选题
| A. | CCl4和SiCl4的熔点 | B. | NH3与H2O的键角 | ||
| C. | SO2和CO2在水中的溶解度 | D. | 碳化硅和金刚石的硬度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C、13C、14C、石墨都是碳元素的同位素 | |
| B. | 同种元素的原子,质量数一定相同 | |
| C. | 互为同位素的原子,质子数一定相同 | |
| D. | 由一种元素组成的物质,一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
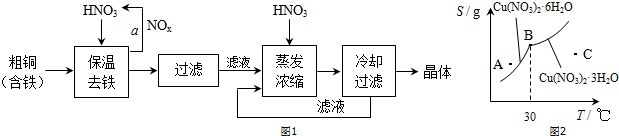
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ④⑤⑥ | C. | ①③④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制浓硫酸和浓硝酸的混酸时,将浓硝酸沿壁缓缓倒入到浓硫酸中 | |
| B. | 要鉴别己烯中是否混有少量甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液 | |
| C. | 除去溴苯中少量的溴,可以加水后分液 | |
| D. | 制硝基苯时,将盛有混合液的试管直接在酒精灯火焰上加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
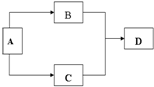 由主族元素组成的A、B、C、D四种常见物质,有如图所示转换关系(部分反应物、生成物没有列出).且四种物质均含有同一种元素.
由主族元素组成的A、B、C、D四种常见物质,有如图所示转换关系(部分反应物、生成物没有列出).且四种物质均含有同一种元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 该温度下HB的电离平衡常数约等于1.11×10-5 | |
| B. | 当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,则$\frac{c({B}^{-})}{c({A}^{-})}$减小 | |
| C. | 相同条件下NaA溶液的pH大于NaB溶液的pH | |
| D. | 溶液中水的电离程度:a=c>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com