
【题目】下列说法不正确的是( )
A.用容量瓶配制溶液时,先用蒸馏水洗涤,再用待装液润洗
B.用蒸馏法可由含有Fe3+的自来水获取较纯净的水
C.焰色反应后用稀盐酸洗涤铂丝并在火焰上灼烧至无色,再进行其它物质的测试
D.金属镁着火可用沙子覆盖
科目:高中化学 来源: 题型:
【题目】运用所学知识回答下列问题.
(1)0.5molCH4中含有个甲烷分子(阿伏加德罗常数用NA表示),在标准状况下的体积为 L.0.1molH2SO4中含 molH原子,溶于水配成100mL水溶液后c(H+)= .
(2)在反应3Zn+2Fe3+═3Zn2++2Fe中,Fe3+是(填“氧化”或“还原”)剂,1molZn完全反应转移的电子数为 mol.
(3)选择下列实验方法分离物质,将分离方法的序号填在横线上(单选).
A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
①分离粗盐中混有的泥沙 . ②分离碘和水的混合物 .
③分离水和汽油的混合物 . ④分离酒精和水的混合物 .
(4)有下列三组物质①CaO、SO3、SO2、P2O5 ②HNO3、H2SO4、HCl、NaCl③KClO3、KCl、KMnO4、HgO各组中均有一种物质所属类别与其他物质不同,这三种物质分别是:①;②;③ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6molL﹣1 H2SO4溶液中,乙同学将电极放入6molL﹣1的NaOH溶液中,如图所示.
请回答:
(1)写出甲池中正极的电极反应式: .
(2)写出乙池中负极的电极反应式和总反应的离子方程式:负极 , 总反应的离子方程式为 .
(3)由此实验,可得到如下哪些正确结论?(填写字母序号).a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(4)上述实验也反过来证明了“直接利用金属活动性顺序判断原电池中的正负极”,这种做法(填“可靠”或“不可靠”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是现代光学及光纤制品的基本原料,它能被NaOH溶液或氢氟酸腐蚀.A与NaOH溶液反应生成B和水,B的焰色反应呈黄色,若向B的水溶液中滴加稀盐酸能生成一种胶体D.请回答下列问题:
(1)A的化学式是 .
(2)B的水溶液俗称 .
(3)A与氢氟酸反应的化学方程式是 .
(4)B与稀盐酸反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W,X,Y,Z是短周期元素,其部分性质如下表:
元素 | 部 分 性 质 |
W | 单质是淡黄色固体 |
X | 在地壳中的含量居第二位 |
Y | 原子最外层电子数是核外电子总数的 |
Z | 第三周期原子半径最小的金属 |
下列说法不正确的是( )
A.第一电离能:Y>Z
B.离子半径:W>Z
C.X,Y形成的化合物XY4是离子化合物
D.工业上利用电解熔融Z的氧化物生产Z金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为元素周期表的一部分,X,Y,W,Z均为短周期元素,其中只有X为金属元素.下列说法错误的是( ) ![]()
A.原子半径:Z<W<Y<X
B.元素Y的氧化物能与NaOH溶液反应
C.最简单气态氢化物的热稳定性:Y<X
D.W,Z的氧化物都能与碱反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是炼钢和炼铜的主要原料,在高温下灼烧生成三氧化二铁和氧化亚铜.三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某学校化学兴趣小组通过实验来探究﹣红色粉末是Fe2O3、Cu2O或两者的混合物,探究过程如下:[查阅资料]Cu2O溶于稀硫酸生成Cu和CuSO4 , 在空气中加热生成CuO.
[提出假设]假设1:红色粉末是Fe2O3 .
假设2:红色粉末是Cu2O.
假设3:红色粉末是Fe2O3和Cu2O的混合物.
[提出探究实验]取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂.
(1)若假设1成立,则实验现象是 .
(2)滴加KSCN试剂后溶液不变红色,某同学认为原固体粉末中一定不含三氧化二铁,你认为这种说法合理吗? . 简述你的理由(不需要写出反应的化学方程式) .
(3)若固体粉末完全溶液无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是 , 写出发生的氧化还原反应的离子方程式: .
(4)[探究延伸]经试验分析,确定红色粉末为Fe2O3和Cu2O的混合物.实验小组称取3.04g该红色粉末,设计如下实验方案进行实验.经查资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀时的pH | 6.0 | 7.5 | 1.4 |
沉淀完全时的pH | 13 | 14 | 3.7 |
步骤Ⅰ:将3.04g红色粉末溶于足量稀硫酸中,再加入足量H2O2溶液,振荡,得澄清透明溶液X.
步骤Ⅱ:在溶液X中加入适量Cu(OH)2粉末,调节溶液pH=4.0,过滤,得红褐色沉淀Y和滤液Z.
步骤Ⅲ:将沉淀Y充分灼烧,得1.6g红色固体M.
步骤Ⅳ:将滤液Z蒸发浓缩,冷却结晶,过滤,得6.0gCuSO45H2O晶体.
①沉淀Y的化学式为 .
②步骤Ⅳ中不需要用到的实验仪器 .
a.烧杯b.玻璃棒c.分液漏斗d.酒精灯e.铁架台(带铁圈)f.托盘天平g.量筒h.蒸发皿i.容量瓶.
③红色粉末样品中Cu2O的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,0.1molL﹣1的HA溶液中 ![]() =1×10﹣8 , 下列叙述中正确的是( )
=1×10﹣8 , 下列叙述中正确的是( )
A.0.01 molL﹣1HA的溶液中 c(H+)=l×l0﹣4molL﹣1
B.pH=3的HA溶液与pH=ll的NaOH溶液等体积混合后所得溶液中:c(Na+)=c(A﹣)>c(OH﹣)=c(H+)
C.浓度均为0.1 molL﹣1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则c(H+)﹣c(OH﹣)>c(A﹣)﹣c(HA)
D.pH=3的HA溶液与pH=11的NaOH溶液混合后所得溶液显碱性,则 c(Na+)>c(A﹣)>c(OH﹣)><c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下海带提碘的实验方案可以缩短实验时间,避免Cl2和CCl4的毒性.其实验流程如下: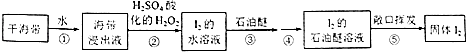
回答下列问题:
(1)步骤①的操作名称是;所需玻璃仪器有玻璃棒、烧杯和 .
(2)步骤②中加入H2O2后发生反应的化学方程式为;选择用H2O2做氧化剂的原因是 .
(3)检验I2的水溶液中含有单质碘的方法是,取样于试管中,加入淀粉,如溶液显色,则可证明含有碘单质.
(4)步骤③的操作名称是;石油醚能用作萃取剂,说明石油醚具有的性质是 .
(5)步骤⑤通过敞口挥发就能得到固体碘,说明石油醚具有良好的 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com