
【题目】通过溶解、过滤、蒸发等操作,可将下列各组固体混合物分离的是( )
A. 硝酸钠和氢氧化钠 B. 二氧化锰和氧化铜
C. 氯化钾和二氧化锰 D. 碳酸钾和氯化钙
科目:高中化学 来源: 题型:
【题目】肯定属于同族元素且性质相似的是( )
A. 原子核外电子排布式:A为1s22s2,B为1s2
B. 结构示意图:A为![]() ,B为
,B为![]()
C. A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物在材料领域中应用广泛,下列说法正确的是( )
A.制取普通玻璃是以纯碱、黏土、石英砂为主要原料
B.二氧化硅是太阳能转换为电能的常用材料
C.石棉(CaMg3Si4O12)表示为CaO·3MgO·4SiO2
D.水晶、玻璃、陶瓷的主要成分都属于硅酸盐制品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol H—H键的键能是436kJ,1 mol I—I键的键能是151kJ,1 mol H—I键的键能是299kJ,则对反应H2(g)+I2(g)![]() 2HI(g)的说法,不正确的是 ( )
2HI(g)的说法,不正确的是 ( )
A.放热反应B.吸热反应C.化合反应D.可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或做法正确的是( )
A.金属离子只有氧化性,非金属离子只有还原性
B.硫酸亚铁溶液中需加入还原铁粉防止亚铁离子氧化
C.用50mL量筒量取2mL蒸馏水
D.金属钠保存在盛有煤油的细口瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,表中的①—⑩中元素,用化学用语填空回答:
族 周期 | I A | IIA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
四 | ⑨ | ⑩ |
(1)在这些元素中,⑩最高价氧化物的水化物为__________。
(2)写出①的最高价氧化物和②的单质的电子式_________,________。
(3)用电子式表示③与④形成化合物的过程______________________。
(4)①的单质和⑥的氧化物反应的化学方程式______________________。
(5)写出⑤的单质与氢氧化钠反应的化学方程式:________________________写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:_____________________。
(6)已知拆开l mol C—H键、l mol O=O键、l molC=O键、l mol H—O键分别需要吸收的能量为414kJ、498kJ、728kJ、464kJ。则l mol甲烷完全燃烧放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+的电子层结构与Ne相同,Z的质子数为偶数,室温下M的单质为淡黄色固体,下列有关说法正确的是( )
A.Y单质能在X的最高价氧化物中燃烧,发生置换反应
B.X、Z、M的最简单气态氢化物的热稳定性依次增强
C.X、Y、Z、M的原子半径依次减小
D.化合物![]() 的熔点高于化合物YM的熔点
的熔点高于化合物YM的熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.NO是第一个被发现的生命体系气体信号分子,具有舒张血管的功能。工业上可用“氨催化氧化法”生产NO,主要副产物为N2。请回答下列问题:
(1)以氨气、氧气为原料,在催化剂存在下生成NO和副产物N2的热化学方程式如下:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H1①,4NH3(g)+3O2(g)
4NO(g)+6H2O(g) △H1①,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H2②,N2(g)+O2(g)
2N2(g)+6H2O(g) △H2②,N2(g)+O2(g)![]() 2NO(g) △H3③,则上述反应热效应之间的关系式为△H3 =___________________。
2NO(g) △H3③,则上述反应热效应之间的关系式为△H3 =___________________。
(2)某化学研究性学习小组模拟工业合成NO的反应。在1110K时,向一恒容密闭容器内充入1mol NH3和2.8mol O2,加入合适催化剂(催化剂的体积大小可忽略不计),保持温度不变,只发生反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0。
4NO(g)+6H2O(g) △H<0。
①下列各项能说明反应已达到化学平衡状态的是_______。(填字母序号)
a.5c(NH3)=4c(O2)
b.N-H键的生成速率与O-H键的生成速率相等
c.混合气体的压强不变
d.混合气体的密度不变
②若其他条件不变,将容器改为恒容的绝热容器,在达到平衡后的体系温度下的化学平衡常数为K1,则K1_____K(填“>”、“<”或“=”)。
II.(3)某化学研究性学习小组模拟用CO和H2合成甲醇,其反应为:CO(g)+2H2(g) ![]() CH3OH(g)△H<O。在容积固定为1L的密闭容器内充入2mol CO和4 mol H2,加入合适的催化剂(体积可以忽略不计)、保持250℃不变发生上述反应,用压力计监测容器内压强的变化如下:
CH3OH(g)△H<O。在容积固定为1L的密闭容器内充入2mol CO和4 mol H2,加入合适的催化剂(体积可以忽略不计)、保持250℃不变发生上述反应,用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=_______,该温度下平衡常数K=_______。
III.(4)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
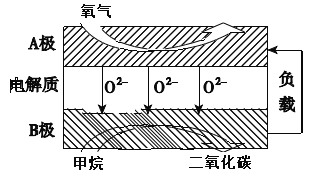
①B极上的电极反应式为_____________。
②若用该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到5.6 L(标准状况)气体时,消耗甲烷的体积为________L(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com