
下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
由Na2CO3·nH2O与NaHCO3组成的混合物28.2 g,放入坩埚中充分加热至质量不变时,将残留固体用足量的盐酸溶解可产生标准状况下的气体3.36 L;若将28.2 g原混合物与盐酸反应,则放出标准状况下气体4.48 L,由此计算。
(1)残留固体质量;
(2)n值;
(3)NaHCO3质量。(写出计算求解的过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如图所示。据图分析,下列判断不正确的是( )
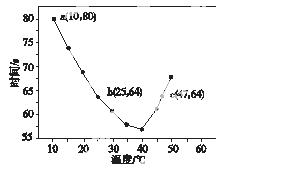
A.40 ℃之前与40 ℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaHSO3反应速率为5.0×10-5 mol·L-1·s-1
D.温度高于40 ℃时,淀粉不宜用作该实 验的指示剂
验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
根据酸碱的质子理论,“凡是能给出质子的分子或离子都是酸;凡是能结合质子的分子或离子都是碱。”按这个理论,下列微粒:
①HS-,②CO32-,③HPO42-,④NH3,⑤OH-,⑥H2O,⑦HCO3-,⑧HAc,⑨KHSO4
(1)只属于碱的微粒是: ;
(2)只属于酸的微粒是: ;
(3)属于两性的微粒是: 。(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
用有关理论解释下列事实:甲学生在制得Mg(OH)2沉淀中加入浓氯化铵溶液,结果沉淀完全溶解,乙学生在制得的Mg(OH)2沉淀中加入浓醋酸铵溶液,结果沉淀也完全溶解。
查看答案和解析>>
科目:高中化学 来源: 题型:
图中a、b是惰性电极,通电2 min后b电极附近溶液呈红色,b电极生成标准状况时的气体体积为0.224 L,NaCl溶液体积为500 mL,下列说法不正确的是( )

A.电解过程中 CuSO4溶液物质的量浓度不变
CuSO4溶液物质的量浓度不变
B.电子流动的方向是由a流向Cu电极
C.电路中通过的电子为0.02 mol
D.电解速率v(OH-)=0.02 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使湿润红色石蕊试纸变蓝的气体,它们之间能发生如下反应:①A+H2O→B+C ②C+F→D ③D+NaOH F+E+H2O
F+E+H2O
(1)写出它们的化学式:A 、B 、C 、D 、E 、F ;
(2)写出各步反应的化学方程式,并指出反应①的氧化剂和还原剂.
① ,氧化剂 、还原剂 .
② .
③ .
(3)工业生产C的过程中有如下一步反应,即F经催化氧化生成B和H2O,写出该步反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
取xg铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8960mL的NO2气体和672mL N2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02g.则x等于( )
|
| A. | 8.64g | B. | 9.20g | C. | 9.00g | D. | 9.44g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com