解答:
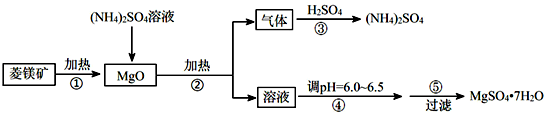
解:(1)步骤②中发生反应的为硫酸铵和氧化镁反应生成氨气、硫酸镁和水,反应的离子方程式为 2NH
4++MgO
Mg
2++2NH
3↑+H
2O,
故答案为:2NH
4++MgO
Mg
2++2NH
3↑+H
2O;
(2)步骤④中将硫酸镁溶液蒸发、结晶时,为了抑制镁离子的水解,调节pH为弱酸性,使镁离子的水解平衡逆向移动,得到纯净的硫酸镁晶体,
故答案为:抑制Mg
2+水解,以便得到较纯的产品;
(3)将MgSO
4?7H
2O晶体直接加热会造成结晶水脱去,硫酸镁较稳定,可以稳定存在,
故答案为:能;
(4)MgSO
4?7H
2O在加热条件下容易失去结晶水,无法得到纯净的MgSO
4?7H
2O,所以从硫酸镁溶液中获得MgSO
4?7H
2O的方法为蒸发浓缩、冷却结晶,
故答案为:蒸发浓缩、冷却结晶;
(5)长时间加热MgCO
3悬浊液后生成Mg(OH)
2,实现了难溶物的转化,反应的化学方程式为:MgCO
3+H
2O
Mg(OH)
2+CO
2↑,
故答案为:MgCO
3+H
2O
Mg(OH)
2+CO
2↑;
(6)25℃时,Mg(OH)
2的溶度积K
sp=5.6×10
-12,根据反应Mg(OH)
2(s)?Mg
2++2OH
-可得:c(Mg
2+)c
2(OH
-)=5.6×10
-12,
设c(OH
-)=2c(Mg
2+)=x,则:0.5x×x
2=5.6×10
-12,
解得:x=2.24×10
-4mol/L,
c(H
+)=
mol/L=4.5×10
-11mol/L,
溶液的pH=10.4>9.6,所以溶液呈蓝色,
故答案为:蓝色;
(7)实验一:取该碱式盐3.01g充分灼烧至恒重,测得固体质量减少了1.30g:减少的是二氧化碳气体和水蒸气的质量,灼烧得到固体为氧化铝和氧化镁的混合物;
实验二:再取该碱式盐3.01g使其溶于足量的盐酸中,产生CO
2的体积为112mL(标准状况),可以计算碳元素物质的量;
实验三:向实验二的溶液中加入足量的NaOH溶液得到1.74g白色沉淀,此1.74g白色沉淀为氢氧化镁沉淀;
生成标况下112mL二氧化碳的物质的量为:n(CO
2)=
=0.005mol,
3.01g碱式碳酸盐中,含:n(Mg
2+)=n[Mg(OH)
2]=
=0.03mol,
Al
2O
3和MgO质量为:3.01g-1.30g=1.71g,依据元素守恒计算得到:n(Al
2O
3)=
=0.005mol,
3.01g该碱式盐中含有碳酸根离子的物质的量为:n(CO
32-)=n(CO
2)=0.005mol,
根据电荷守恒可得:n(OH
-)=2n(Mg
2+)+3n(Al
3+)-2n(CO
32-)=0.03mol×2+0.005mol×2×3-0.005mol×2=0.08mol,
3.01g碱式盐中含有的结晶水的物质的量为:n(H
2O)=
| 1.30g-0.08mol××18g/mol-44g/mol×0.005mol |
| 18g/mol |
=0.02mol,
所以:n(Al
3+):n(Mg
2+):n(OH
-):n(CO
32-):n(H
2O)=0.01mol:0.03mol:0.08mol:0.005mol:0.02mol=2:6:16:1:4,
即碱式碳酸盐的化学式为:Al
2Mg
6(OH)
16CO
3?4H
2O,
故答案为:Al
2Mg
6(OH)
16CO
3?4H
2O.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案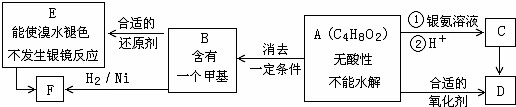
 (注:R、R’为烃基)
(注:R、R’为烃基)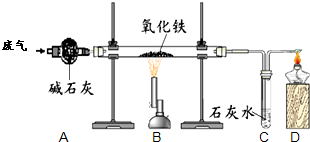 某课外小组的同学收集了含水蒸气、一氧化碳和二氧化碳的废气,为确认这种废气中存在CO,他们在实验室按如图所示装置进行实验〔气体通过装置A速度很慢,假设在此处发生的反应完全;碱石灰(CaO和NaOH的混合物)过量〕.
某课外小组的同学收集了含水蒸气、一氧化碳和二氧化碳的废气,为确认这种废气中存在CO,他们在实验室按如图所示装置进行实验〔气体通过装置A速度很慢,假设在此处发生的反应完全;碱石灰(CaO和NaOH的混合物)过量〕.

 如图所示装置进行实验(图中铁架台等仪器均已略去).在Ⅰ中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊.符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是( )
如图所示装置进行实验(图中铁架台等仪器均已略去).在Ⅰ中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊.符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是( ) 某化学课外活动小组应用如图所示的方法研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气,回答下列问题.
某化学课外活动小组应用如图所示的方法研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气,回答下列问题.