
【题目】四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 | A | B | C | D |
性质 结构 信息 | 核外电子共有7种运动状态 | 原子的M层有1对成对的p电子 | 一种核素的中子数为35、质量数为64 | 有多种同位素,其中一种用做测量相对原子质量的校准 |
(1)写出B原子的电子排布式______。写出C原子的电子排布式______
(2)四种元素中非金属性最强的元素是______,金属性最强的元素是______,第一电离能最大的元素是______;
(3)一定条件下B、C单质间能反应,相应的反应方程式为______。
(4)已知S+6HNO3=H2SO4+6NO2↑+2H2O,该反应表明利用硝酸可以制取硫酸,但该反应不能用于说明氮元素的非金属性比硫元素的强,理由是______。
【答案】1s22s22p63s23p4 1s22s22p63s23p63d104s1 N Cu N S+2Cu![]() Cu2S 产物不是单质氮气
Cu2S 产物不是单质氮气
【解析】
A核外电子运动状态7种,为N元素;B原子的M层有1对成对的p电子,为S元素;C的一种核素的中子数为35、质量数为64,质子数=64-35=29,为Cu元素;D有多种同位素,其中一种用做测量相对原子质量的校准,为C元素,据此分析解答。
根据上述分析,A为N元素,B为S元素,C为Cu元素,D为C元素。
(1)B为S元素,核电荷数=16,电子排布式为:1s22s22p63s23p4,C为Cu元素,d能级全满为稳定结构,电子排布式:1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p4;1s22s22p63s23p63d104s1;
(2)同一周期,从左向右,金属性减弱,非金属性增强;同一主族,从上到下,金属性增强,非金属性减弱;非金属性最强的是N元素,金属性最强的是Cu元素;同一周期,从左到右,元素的第一电离能逐渐增大,但第IIA族、第VA族元素的第一电离能大于相邻元素,同一主族,从上到下,第一电离能逐渐减小,第一电离能最大的是N,故答案为:N;Cu;N;
(3)铜为变价金属和氧化性弱的硫单质反应生成低价化合物硫化亚铜,反应的化学方程式:S+2Cu![]() Cu2S,故答案为:S+2Cu
Cu2S,故答案为:S+2Cu![]() Cu2S;
Cu2S;
(4)非金属性强弱的判断依据是最高价含氧酸的酸性,强酸制备弱酸为复分解反应,也可以通过单质间的置换反应判断。S+6HNO3=H2SO4+6NO2↑+2H2O反应是氧化还原反应,反应中硫单质反应生成的氮元素不是氮气,不能证明非金属性强弱,故答案为:产物不是单质氮气。


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:
【题目】我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示(吸附在金催化剂表面上的物种用·标注)。

下列说法正确的是( )
A.水煤气的变换反应是吸热反应
B.该历程中逆向的最大能垒(活化能)E逆=2.02eV
C.催化剂能够使物质的能量升高
D.反应历程中,生成过渡态I比过渡态II容易
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配平下列方程式(不需写出配平过程)
________H2S+_______HNO3 =________S↓ +________NO↑ +_______H2O
________S+________KOH=________K2S+________K2SO3 +________H2O
________KMnO4+________HCl(浓)=________KCl+________MnCl2+________Cl2↑+________H2O
(2)在酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O![]() 还原为Cr3+,该过程的离子反应方程式为________________________。
还原为Cr3+,该过程的离子反应方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
![]()
A. 氢氧燃料电池工作时,![]() 在负极上失去电子
在负极上失去电子
B. ![]() 溶液加热后,溶液的pH减小
溶液加热后,溶液的pH减小
C. 常温常压下,![]() 中含有的分子数为
中含有的分子数为![]() 个
个
D. 室温下,稀释![]() 溶液,溶液的导电能力增强
溶液,溶液的导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1 molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应H2(g)+I2(g) ![]() 2HI(g),下列说法正确的是
2HI(g),下列说法正确的是
A. 保持容器容积不变,向其中加入1molH2,化学反应速率不变
B. 保持容器容积不变,向其中加入1molAr,化学反应速率增大
C. 保持容器内气体压强不变,向其中加入1molAr,化学反应速率不变
D. 保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),化学反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3 + 5O2 === 4NO + 6H2O 在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为:( )
A.v (O2)=0.01 mol/(L·s)B.v (NO)=0.008 mol/(L·s)
C.v (H2O)=0.015 mol/(L·s)D.v (NH3)=0.002 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
2 mL | 0.2 mol·L1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol·L1 CuSO4溶液 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol·L1 Al2(SO4) 3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1) 经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:_____。
(2) 经检验,现象Ⅱ的棕黄色沉淀中不含SO42,含有Cu+、Cu2+和SO32。
已知:Cu+![]() Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+![]() CuI↓(白色) +I2。
CuI↓(白色) +I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32。
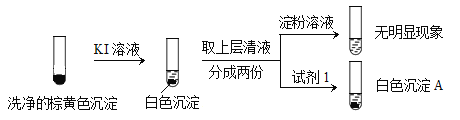
a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu2+和SO32的理由是___________。
(3) 已知:Al2(SO4) 3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:
i.被Al(OH) 3所吸附;
ii.存在于铝的碱式盐中。
对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。
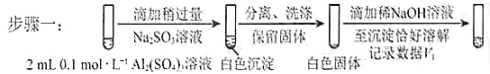
步骤二:_____________(按上图形式呈现) 。
(4) 根据实验,亚硫酸盐的性质有______。盐溶液间反应的多样性与___有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以NH4Cl酸性蚀铜废液[含NH4Cl,Cu(NH3)4Cl2、CuCl、CuSO4及盐酸等]为原料制备CuCl并回收Cu(OH)2的工艺流程如图:
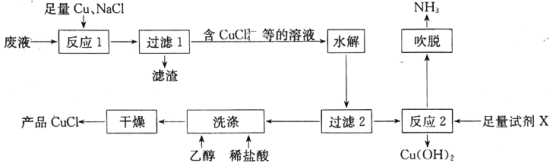
已知:CuCl溶于浓盐酸,难溶于水,不溶于乙醇。
回答下列问题:
(1)“反应1”中,NaCl、Cu与CuSO4反应的离子方程式为__;生产中常将“过滤1”的滤渣返回到“反应1”中,其目的是__。
(2)“水解”步骤中,溶液中的CuCl43-在加入大量水稀释即可析出CuCl,原因是__(结合离子方程式,从平衡角度分析)。
(3)湿的CuCl在空气中易被氧化为Cu2(OH)3Cl,该反应的化学方程式为__。
(4)“反应2”需加入的试剂X是__;“吹脱”出来的NH3可用于生产碳铵化肥,主要反应的化学方程式为__。
(5)测定产品中CuCl质量分数的步骤如下:称取ag产品,加入稍过量的FeCl3溶液,待溶解后用邻菲罗啉作指示剂,立刻用cmol·L-1的Ce(SO4)2标准溶液滴定到终点,消耗标准溶液VmL。则产品中CuCl的质量分数为__(已知滴定反应为Ce4++Fe2+=Ce3++Fe3+,列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.25℃时,欲使醋酸溶液pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com