
右图是关于反应A2(g)+3B2(g)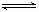 2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
A.升高温度,同时加压 B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时使用催化剂

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是( )。
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1 :1
D.X2Y可能是离子化合物,也可能是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列事实不能说明上述观点的是
A.苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应
B.乙烯能发生加成反应,乙烷不能发生加成反应
C.甲苯能使酸性高锰酸钾溶液褪色,乙烷、苯不能使酸性高锰酸钾溶液褪色
D.苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中A、B、C、D、E、F、G均为 有机化合物。根据上图回答问题:
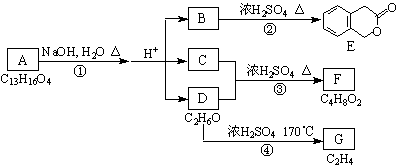
(1)D的化学名称是 。
(2)反应③的化学方程式是 。
(有机物须用结构简式表示,下同)
(3)B的分子式是 ,A的结构简式是 。反应①的反应类型是 。
(4)符合下列3个条件的B的同分异构体的数目有多个。
i)含有邻二取代苯环结构、ii)与B有相同官能团、
iii)不与FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式 。
(5)反应④的化学方程式是 。
G是重要的工业原料,用化学方程式表示G形成高聚物的反应
。
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是( )

A.4>2>1>3 B.2>1>3>4
C.4>2>3>1 D.3>2>4>1
查看答案和解析>>
科目:高中化学 来源: 题型:
把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为 ( )
A.1︰2︰3 B.3︰2︰1 C.6︰3︰1 D.6︰3︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是 ( )
后,使c、d两点短路.下列叙述正确的是 ( )

A.a为直流电源的负极 B.d极发生的反应为2H++2e-=H2↑
C.f电极为锌板 D.e极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g)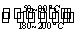 Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移, H减小
H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+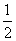 O2(g)==CO(g)
O2(g)==CO(g)  H=-Q1 kJ
H=-Q1 kJ mol-1
mol-1
C(s)+ O2(g)==CO2(g)  H=-Q2 kJ
H=-Q2 kJ mol-1
mol-1
S(s)+O2(g)==SO2(g)  H=-Q3 kJ
H=-Q3 kJ mol-1
mol-1
则SO2(g)+2CO(g)==S(s)+2CO2(g)  H= 。
H= 。
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图28(3)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时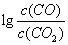 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。
700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。

(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图28(4)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com