
| A. | 被还原 | B. | 被氧化 | ||
| C. | 有可能被氧化,也有可能被还原 | D. | 由高价态变为零价 |
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸亚铁与氢氧化钠溶液混合生成氢氧化亚铁和硫酸钠的反应属于氧化还原反应 | |
| B. | Fe0与一氧化碳反应得到单质铁属于置换反应 | |
| C. | 在自然界中不存在铁单质 | |
| D. | 炽热的铁丝在充满氧气的集气瓶中发生化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
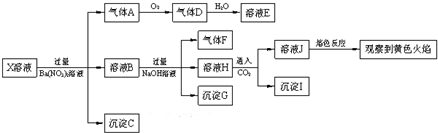
| A. | X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- | |
| B. | 气体F在足量氧气中经催化氧化不可直接生成气体D | |
| C. | 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH )3 | |
| D. | X中不能确定的离子是Fe2+、SO32-、K+和C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是单质参加的化合反应都是氧化还原反应 | |
| B. | 碱性氧化物均是金属氧化物 | |
| C. | 金属单质在参加的反应中只能作还原剂 | |
| D. | 非金属单质在参加的反应中只能作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铜与盐酸; 氢氧化铜与醋酸 | |
| B. | 氯化钡溶液与硫酸铜溶液; 氢氧化钡溶液与硫酸铜溶液 | |
| C. | 碳酸氢钠溶液与稀硫酸 碳酸钠溶液与稀硫酸 | |
| D. | 石灰石与稀硝酸 石灰石与稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 2014 年西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| C. | 金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,不可用泡沫灭火器灭火 | |
| D. | 在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com