


科目:高中化学 来源: 题型:
| A、一定有SO32-离子 |
| B、一定有Cl-离子 |
| C、一定有CO32-离子 |
| D、不能确定HCO3-离子是否存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ①A、B、C、D、E、F为短周期主族元素,原子半径大小关系为A<D<C<B<F<E; |
| ②A与D形成的化合物常温下为液态; |
| ③B元素原子价电子(外围电子)排布为nsnnpn |
| ④F元素原子的核外p电子总数比s电子总数多1; |
| ⑤第一电子能:F<E; |
| ⑥G的基态原子核外有6个未成对电子; |
| ⑦H能形成红色(或砖红色)的H2D和黑色的HD两种化合物. |

查看答案和解析>>
科目:高中化学 来源: 题型:
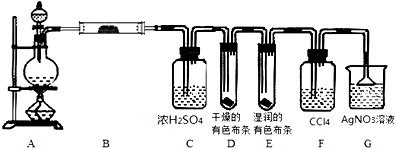
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K1 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 起始浓度 | 甲 | 乙 | 丙 |
| c(CO2)(mol?L-1) | 0.01 | 0.02 | 0.02 |
| c(H2)(mol?L-1) | 0.01 | 0.01 | 0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Cl2通入含1molFeBr2的溶液中 Cl2+Fe2++2Br-=Fe3++Br2+2Cl- | ||
B、少量的NaHSO4加到足量的Ba(OH)2溶液中 H++S
| ||
C、少量的石灰水加到足量的NaHCO3溶液中 Ca2++OH-+HC
| ||
| D、氧化铜与盐酸反应 O2-+2H+═H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com