
| A����NaHA��Һ��һ���У�c(Na��)��c(H��)��c(HA��)��c(OH��)��c(A2-) |
| B����0.1mol��L��1Na2CO3��Һ�У�c(OH��)==c(HCO3��)��c(H+)+ c(H2CO3) |
| C��pH>7��NaCN��HCN�Ļ����Һ��һ���У�c(Na��)��c(CN��) >c(OH��) >c(H+) |
| D��pH>7��CH3COONa��NaOH�Ļ����Һ��һ���У�c(Na+)>c(CH3COO��) >c(OH��) >c(H+) |
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.1mol/LNaHCO3��Һ��c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
| B�������£���0.01mol/LNH4HSO4��Һ�еμӵ����0.01mol/LNaOH��Һ�� c(Na+)=c(SO42-)>c(NH4+).>c(H+)>c(OH-) |
| C��Na2CO3��Һ��c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) |
| D��25��ʱ��Ũ�Ⱦ�Ϊ0.1mol/L��CH3COOH��CH3COONa�������ϣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 )= ��
)= ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

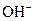 ��H+��
��H+��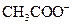 ��Na+�������ӣ�ijͬѧ�Ʋ�������Ũ�ȴ�С˳�����������ֹ�ϵ��
��Na+�������ӣ�ijͬѧ�Ʋ�������Ũ�ȴ�С˳�����������ֹ�ϵ��

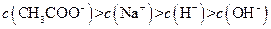


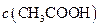 (�<������>����=��)�����ǰ
(�<������>����=��)�����ǰ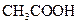 ��Һ�е�
��Һ�е�
 ��Һ�е�
��Һ�е�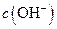 (�<������>����=��)��
(�<������>����=��)���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����pH�İ�ˮ��KOH��Һ��Ba(OH)2��Һ�У�c(NH4+)=c(K+)=c(Ba2+) |
| B��0.2mol/L��NaHSO4��Һ�У�c(Na+)>c(SO42��)> c(H+) > c(OH��) |
C����NH4HCO3��Һ�еμ�NaOH��Һ�����ԣ�c(NH4+)+c(Na+)= c (HCO3��)+c(CO32��) (HCO3��)+c(CO32��) |
| D��0.1 mol/L pH=9��NaNO2��Һ�У�c(Na+)>c(NO2��)>c(OH��) >c(H+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��c��H+��<c��OH����=c��A����<c��B+�� |
| B��c��OH����<c��H+��<c��B+��<c��A���� |
| C��c��H+��<c��OH����<c��A����<c��B+�� |
| D��c��A����= c��B+��>c��H+��=c��OH���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��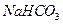 �� �� �� �� �� ��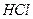 |
B��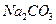 �� �� �� ��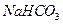 �� �� |
C��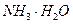 �� ��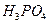 �� �� �� �� |
D��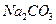 �� ��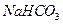 �� �� �� �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������Һ���ܳ����ԣ�Ҳ���ܳʼ��Ի����� |
| B��ֻ��������狀�����Ļ����Һ |
| C������Ũ���ɴ�С��˳���ǣ�c��NH4����>c��SO42����>c��H����>e��OHһ�� |
| D������Ũ�ȴ������й�ϵ��c��NH4����+c��H����=c��OHһ��+c��SO42���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com