
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性能将Fe氧化成Fe3+ |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| C | 常温下分别测定浓度均为0.2mol/L的HClO溶液和0.1mol/LH2SO4溶液的pH | pH:HClO>H2SO4 | 非金属性:S>Cl |
| D | 向某溶液中滴加浓NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.稀硝酸溶液中加入过量铁粉充分反应后,生成硝酸亚铁,滴加硫氰化钾溶液后不会变红;
B.AgNO3溶液中滴加过量氨水,生成银氨溶液;
C.次氯酸不是最高价含氧酸,无法比较S、Cl的非金属性;
D.滴加浓NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸变蓝,可知生成气体为氨气.
解答 解:A.稀硝酸溶液中加入过量铁粉充分反应后,生成硝酸亚铁,若滴加KSCN溶液,溶液不会变红,故A错误;
B.AgNO3溶液中滴加过量氨水,生成银氨溶液,溶液澄清,可知Ag+与NH3•H2O反应生成络离子不能大量共存,故B错误;
C.HClO不是最高价含氧酸,无法据此判断S、Cl的非金属性,故C错误;
D.滴加浓NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸变蓝,可知生成气体为氨气,则该溶液中存在NH4+,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及现象、离子的检验为解答的关键,侧重分析与实验能力的考查,注意元素化合物与实验的结合及实验的评价性分析,题目难度不大.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题

| A. | 同分异构体 | B. | 同素异形体 | C. | 同位素 | D. | 同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2O2与足量KMnO4反应,转移电子数为2NA | |
| B. | 4.4g CO2和N2O的混合气体含有的原子数为0.3NA | |
| C. | 22.4L NH3含有的电子数为10NA | |
| D. | 25℃、101kPa,2.24LCH4含有的共价键数小于0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 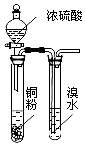 用图所示装置验证浓硫酸具有强氧化性 | |
| B. | 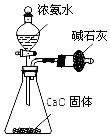 用图所示装罝制取干燥的 NH3 | |
| C. | 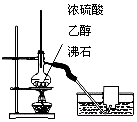 用图所示装置制取并收集乙烯 | |
| D. | 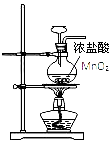 用图所示装置制取 Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用含微量NaF的牙膏,可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F以防止蛀牙,则一般可说明后者的Ksp小于前者的Ksp | |
| B. | 室温下向苯和含少量苯酚杂质的混合溶液中加入适量浓溴水,振荡,静置后过滤,可除去苯中少量苯酚杂质 | |
| C. | 用1.00mol/L 标准盐酸滴定未知浓度的NaOH溶液10.00mL,滴定前将25.00mL 酸式滴定管中盐酸调至“0”刻度,将盐酸滴完恰好滴定至终点,则可得c(NaOH)=2.50mol/L | |
| D. | 向4ml 2%的CuSO4溶液中加入几滴1%的NaOH溶液,振荡后再加入0.5mL 有机物X,加热后未出现砖红色沉淀,说明X结构中不含有醛基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W与其他四种元素形成的二元化合物中其化合价均为+1 | |
| B. | X与Y形成的化合物溶于水后溶液呈碱性 | |
| C. | 最高价氧化物的水化物的酸性:M>Z | |
| D. | 简单离子半径:W<Y<X<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 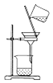 用装置分离Fe(OH)3胶体和NaCl溶液 | |
| B. | 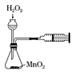 用装置定量测定H2O2的分解速率 | |
| C. |  用装置将CuSO4•5H2O变无水CuSO4 | |
| D. | 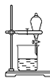 用装置④分离饱和Na2CO3溶液和CH3COOCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | B. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | ||
| C. | 3Mg+Fe2O3═3MgO+2Fe | D. | Al+Fe2O3═Al2O3+Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
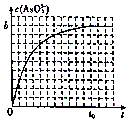 砷(As)是第四周期第VA族的元素,能形成多种化合物.回答下列问题:
砷(As)是第四周期第VA族的元素,能形成多种化合物.回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com