
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是

已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
【答案】B
【解析】A.由图知,碳棒与电源正极相连是电解池的阳极,电极反应4OH--4e-=2H2O+O2↑,故A正确;B.镀镍铁棒与电源负极相连是电解池的阴极,电极反应Ni2++2e-=Ni.电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl-分别通过阳离子膜和阴离子膜移向B中,这使B中NaCl溶液的物质的量浓度不断增大,故B错误;C.因Ni2+在弱酸性溶液中易发生水解;氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度),为了提高Ni的产率,电解过程中需要控制废水pH,故C正确;D.若将图中阳离子膜去掉,由于放电顺序Cl->OH-,则Cl-移向阳极放电:2Cl--2e-=Cl2↑,电解反应总方程式会发生改变,故D正确;故选B。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成气态分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期元素中原子半径最大的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13 个电子。则
(1)B的原子结构示意图为 ;X的化学名称为 。
(2)B单质的电子式为 ;E的气态氢化物的结构式为 ;C与D形成的两种化合物中,原子个数比为1:1的那种物质所含有的化学键为 ,该物质属于 (填“离子化合物”或“共价化合物”)。
(3)B、C、E分别与A形成的化合物中最稳定的是 (写化学式)。
(4)D是同周期简单阳离子中离子半径最 的元素。
(5)F的单质在反应中常作 剂(填“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙醇的燃烧热为 △H= -a kJ·mol-1,则乙醇燃烧的热化学方程式可表示为:C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)H= -a kJ·mol-1
B. 稀硫酸与稀 NaOH 溶液反应的中和热为-57.3 kJ/mol
C. S(g)+O2(g)=SO2(g) △H= -a kJ·mol-1,S(s)+O2(g)=SO2(g) △H= -b kJ·mol-1,则 a>b
D. 500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭的容器中充分反应生成 NH3(g),放热 19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) H= -38.6kJ·mol-1
2NH3(g) H= -38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
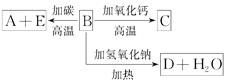
【题目】A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示。A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。
请填空:
(1)形成单质A的原子的结构示意图为________,它的最高化合价为________。
(2)B的化学式为_______________,B和碳反应生成A和E的化学方程式为_________________________。
(3)C的化学式为________,D的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E原子序数依次增大,结合下列信息:A原子核外电子总数是内层电子数的三倍,A、E同主族;B的最高价氧化物对应的水化物F与其气态氢化物G反应,得到离子化合物H;C的焰色应呈黄色;D在同周期中形成的简单离子,其离子半径最小;
回答下列问题:
(1)写出D在元素周期表中的位置:______________。
(2)化合物H的水溶液pH_______7(填“大于”、“等于”“小于”),其原因是______________用离子方程式表示。
(3)上述元素的最高价氧化物对应水化物中,有一种物质在一定条件下均能与其他四种物质发生化学反应,写出该物质的电子式:_______。
(4)请设计实验证明A、B、E的非金属性强弱关系:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大量燃煤产生烟气会造成空气中二氧化硫含量增多,某研究小组利用燃煤电厂的固体废弃物粉煤灰(主要含Al2O3、SiO2等)进行烟气脱硫研究,并制备Al2(SO4)3·18H2O。
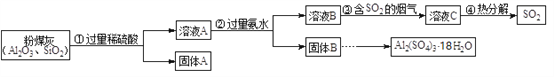
(1)上述①②③④步实验操作中,需要过滤的是______。
(2)第②步不能用氢氧化钠溶液的原因是______(用化学方程式表示)。
(3)下列关于步骤③、④的说法正确的是______。
a.溶液C可用于制备氮肥
b.溶液B中的硫酸铵将烟气中的SO2除去
c.热分解获得的SO2可以回收再利用
(4)从固体B制备Al2(SO4)3·18H2O的实验操作是:加入稀硫酸、加热浓缩、______、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于烷烃性质的叙述,错误的是
A. 烷烃不能使酸性高锰酸钾溶液褪色
B. 烷烃都能燃烧
C. 烷烃在水中的溶解度随着碳原子数的增加而增大
D. 烷烃都能发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com