
【题目】将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )
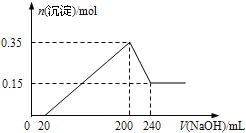
A.Mg和Al的总质量为8g B.硫酸的物质的量浓度为5mol/L
C.NaOH溶液的物质的量浓度为5mol/L D.生成的H2在标准状况下的体积为11.2L
【答案】C
【解析】
试题分析:根据图可知,0~20mL发生酸碱中和,20~200mL发生离子与碱生成沉淀的反应,200~240mL发生Al(OH)3+NaOH=NaAlO2+2H2O,200mL时生成沉淀最多,溶液中的溶质为硫酸钠。A、由图象可知,氢氧化镁的物质的量为0.15mol,则n(Mg)=n[Mg(OH)2]=0.15mol,溶解的氢氧化铝的物质的量为:0.35mol-0.15mol=0.2mol,根据铝原子守恒可得:n(Al)=0.2mol,则Mg和Al的总质量为:0.15mol×24g/mol+0.2mol×27g/mol=9g,故A错误;B、由200~240mL发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,消耗氢氧化钠的物质的量为0.2mol,则c(NaOH)=![]() =5mol/L,200mL时生成沉淀最多,溶液中的溶质为硫酸钠,则c(H2SO4)=
=5mol/L,200mL时生成沉淀最多,溶液中的溶质为硫酸钠,则c(H2SO4)= =1mol/L,故B错误;C、在加入240mLNaOH溶液时,Al(OH)3恰好全部转化为NaAlO2,由B的计算可知氢氧化钠溶液的浓度为5molL-1,故C正确;D、与硫酸反应生成的氢气的体积应为(0.15mol+0.3mol)×22.4 Lmol-1=10.08L,故D错误;故选C。
=1mol/L,故B错误;C、在加入240mLNaOH溶液时,Al(OH)3恰好全部转化为NaAlO2,由B的计算可知氢氧化钠溶液的浓度为5molL-1,故C正确;D、与硫酸反应生成的氢气的体积应为(0.15mol+0.3mol)×22.4 Lmol-1=10.08L,故D错误;故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生资源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________。
②在上述制备甲醛时,常向反应器中通入适当过量的氧气,其目的是_________________。
(2)工业上可用如下方法合成甲醛,化学方程式为CO(g)+2H2(g)=CH3OH(g),已知某些化学键的键能数据如下表:
化学键 | C-C | C-H | H-H | C-O | C=O | O-H |
键能/kJ/mol | 348 | 413 | 436 | 358 | x | 463 |
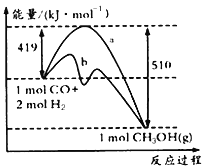
请回答下列问题:
①如图中曲线a到曲线b的措施是_______________。
②已知CO中的C与O之间为三键,其键能为xkJ/mol,则x=___________。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池正极的电极反应式为____________________。
②若以该电池为电源,用石墨作电极电解200mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl- | SO42- |
c/mol/L | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶液现象)阳极上收集到氧气的质量为_____________。
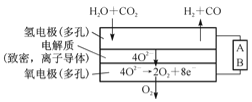
(4)电解水蒸气和CO2产生合成气(H2+CO),较高温度下(70-1000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由右图可知A为直流电源的 (填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
成分的质量/g | 摩尔质量/(gmol-1) | |
蔗糖 | 25.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 0.316 | 158 |
硝酸银 | 0.02 | 170 |
(1)下列“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为__________molL-1(要求:用原始数据写出表达式即可,不需要化简与计算)。
(2)配制上述“鲜花保鲜剂”所需的仪器有烧杯、玻璃棒、药匙、托盘天平(带砝码)、
____________________(填所缺仪器的名称)。
(3)在溶液配制过程中,下列操作对配制结果没有影响的是_________(填字母).
A.定容时,俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)若要配制0.5mol·L-1500ml的硫酸溶液,则:
①所需质量分数为98%、密度为1.84g·cm-3的浓硫酸的体积为___________(计算结果保留一位小数)mL;
②如果实验室有15mL、20mL、50mL量筒,应选用___________mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸稀释,稀释时操作方法是_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g) 若经2s(秒)后测得C的浓度为0.6mol/L,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3mol/(Ls)
②用物质B表示的反应的平均速率为0.6mol/(Ls)
③2S(秒)时物质A和B的转化率一样
④2S(秒)时物质B的浓度为0.3mol/L
其中正确的是( )
A.①③ B.③④ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种可溶物质A、B、C,其中A、B是盐,一种是酸式盐,一种是正盐,C是碱,它们溶于水后电离产生的所用离子如下表所示:
阳离子 |
|
阴离子 |
|
请根据下列叙述回答问题:
(1)C的化学式为_________________。
(2)A溶液与B溶液反应可生成气体X,则X的化学式为_______________________,该反应的离子方程式为___________________.
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸.
①B的化学式为____________,鉴别溶液中B的阴离子的方法是____________________.
②D溶于稀硝酸的离子方程式为________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)
A. 碱式滴定管未用待测液润洗 B. 滴定过程中不慎有液体溅出
C. 滴定前仰视读数,滴定后读数正确 D. 酸式滴定管未用标准盐酸润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20g/㎝3。
(1)此浓盐酸的物质的量浓度是 ?(列式计算)
(2)配制100mL3.00mol/L的盐酸,需以上浓盐酸 mL.(列式计算)
(3)还原4.8g金属氧化物,参加反应的氢气为2.016L(标准状况),生成的金属溶于上述盐酸,放出氢气1.344 L(标准状况),此金属氧化物是 。
A.Fe2O3 B.ZnO C.CuO
(4)将5.0 g CaCO3加入到足量的盐酸中,并将生成的气体全部通入足量的红热的碳中充分反应,可得到气体的体积为 。(折算成标况下)
(5)某金属R与一定体积的上述盐酸正好完全反应所得氯化物溶液20 mL,浓度为0.05 mol/L。它恰好能与20 mL 0.15 mol·L-1 的AgNO3溶液完全反应,则该氯化物的化学式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在生产和生活中应用十分广泛。已知:![]() (浓)=
(浓)= ![]() ,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气。可供选用的发生装置如下图。
,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气。可供选用的发生装置如下图。

(1)若用高锰酸钾固体和浓盐酸反应制取氯气,发生装置是 。(选填A或B或c)
(2)写出用二氧化锰固体和浓盐酸反应制取氯气的化学方程式: 。
(3)实验室收集氯气的方法是 。
(4)常用![]() 溶液吸收氯气防止污染。写出该反应的化学方程式 。
溶液吸收氯气防止污染。写出该反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com