
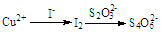
分析 (1)Cu2+与I-反应生成CuI沉淀和I2,原子守恒配平书写得到;
(2)用Na2S2O3标准溶液滴定至终点,溶液放置一段时间后又出现蓝色是因为碘离子具有较强的还原性,易被空气中氧气氧化为碘单质;
(3)元素化合价代数和为0计算;
(4)结晶水含量的测定:另称取1.770g样品于150℃下恒温2h至恒重,称得剩余固体的质量为1.590g,则结晶水的物质的量n(H2O)=$\frac{1.770g-1.590g}{18g/mol}$=0.0100mol,
ⅡK+含量的测定:测得样品中K+的质量分数为22.03%,K+物质的量n(K+)=$\frac{1.770g×22.03%}{39g/mol}$=0.0100mol,
n (Cu2+)=n(Na2S2O3)=0.01000mol•L-1×0.02L×500mL/20mL=0.005 mol,
n(C2O42-)=$\frac{0.005mol×2+0.0100mol}{2}$=0.0100 mol,
计算得到化学式.
解答 解:(1)Cu2+与I-反应生成CuI沉淀和I2,反应的离子方程式为:2Cu2++4I-=2CuI↓+I2,
故答案为:2Cu2++4I-=2CuI↓+I2;
(2)用Na2S2O3标准溶液滴定至终点,溶液放置一段时间后又出现蓝色是因为碘离子具有较强的还原性,易被空气中氧气氧化为碘单质,
故答案为:I-会被空气中的O2氧化成I2 ;
(3)Ka[Cub(C2O4)m]•nH2O中元素化合价代数和为0,+1×a+(+2)×b+(-2)×m=0,
m=$\frac{a+2b}{2}$,
故答案为:$\frac{a+2b}{2}$;
(4)称取1.770g样品溶于热的稀H2SO4中,用KMnO4溶液滴定除去C2O42-;将滴定后的溶液定容至500mL,取20.00mL于锥形瓶中,加入足量KI溶液,与Cu2+反应生成CuI沉淀和I2,以淀粉作指示剂,用0.01000mol•L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.测定过程中物质的转化关系如下:Cu2+~I2~S4O62-,
ⅡK+含量的测定:测得样品中K+的质量分数为22.03%
Ⅲ结晶水含量的测定:另称取1.770g样品于150℃下恒温2h至恒重,称得剩余固体的质量为1.590g.
Ⅲ结晶水含量的测定:另称取1.770g样品于150℃下恒温2h至恒重,称得剩余固体的质量为1.590g,则结晶水的物质的量n(H2O)=$\frac{1.770g-1.590g}{18g/mol}$=0.0100mol,
ⅡK+含量的测定:测得样品中K+的质量分数为22.03%,K+物质的量n(K+)=$\frac{1.770g×22.03%}{39g/mol}$=0.0100mol,
n (Cu2+)=n(Na2S2O3)=0.01000mol•L-1×0.02L×500mL/20mL=0.005 mol,
n(C2O42-)=$\frac{0.005mol×2+0.0100mol}{2}$=0.0100 mol,
a:b:m:n=0.0100:0.005:0.0100:0.0100=2:1:2:2,
化学式为:K2[Cu(C2O4)2]•2H2O,
答:化学式为K2[Cu(C2O4)2]•2H2O.
点评 本题考查了物质组成和性质的探究、组成的测定、化学式计算判断等知识点,掌握基础是解题关键,题目难度中等.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+) | |
| B. | NaHCO3溶液中:c (CO32-)+c(H+)=c(H2CO3)+c(OH-) | |
| C. | 1 L 0.l mol•L-1CuSO4•(NH4)2SO4•6H2O溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向移动 | B. | a+b>c+d | ||
| C. | Z的体积分数减小 | D. | X的转化率下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ③④⑤ | C. | ②④⑥ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “物质的量”是衡量物质重量的物理量 | |
| B. | 氢氧化钠的摩尔质量是40g | |
| C. | 物质的量浓度的常用单位是mol•L-1 | |
| D. | 1mol任何物质所占有的体积都是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨、醋酸溶液、食盐晶体 | B. | 熔融状态的KOH、熔融状态的NaCl | ||
| C. | 稀H2SO4、NaOH溶液、纯HNO3 | D. | 液氨、石灰水、水银 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4可用于鉴别溴水和碘水 | |
| B. | 用AgNO3溶液可以鉴别KCl和KI | |
| C. | 氯水久置后酸性减弱 | |
| D. | 在饱和氯水中通入H2S气体,溶液的酸性增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com