
分析 (1)依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合1个氨气分子含有10个电子解答;
(2)依据n=$\frac{m}{M}$=CV计算解答,溶液具有均一性,浓度与体积无关;
(3)根据n=$\frac{N}{{N}_{A}}$计算出3.01×1023个Cl-的物质的量,再根据化学式MCl2计算出MCl2的物质的量,再根据M=$\frac{m}{n}$计算出M的摩尔质量,摩尔质量在数值上等于其相对原子或分子质量;
(4)依据n=$\frac{m}{M}$=CV,结合1mol硫酸铁电离产生3mol硫酸根离子和2mol铁离子,溶液稀释过程中溶质的物质的量不变计算解答;
解答 解:(1)3.4g氨气中共含有电子数为:$\frac{3.4g}{17g/mol}$×10×NA=2NA,
故答案为:2NA;
(2)将4gNaOH固体溶于水配成250mL溶液,溶液的物质的量浓度C=$\frac{4g}{\frac{40g/mol}{0.25L}}$=0.4mol/L;溶液具有均一性,浓度与体积无关,所以取出的25mL溶液中NaOH的物质的量浓度为0.4mol/L;
故答案为:0.4;
(3)27.75g某+2价金属的氯化物(MCl2)中含有3.01×1023个Cl-,3.01×1023个Cl-的物质的量为:n(Cl-)=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$mol=0.5mol,MCl2的物质的量为:n(MCl2)=$\frac{1}{2}$×0.5mol=0.25mol,M(MCl2)=$\frac{27.75g}{0.25mol}$=111g/mol,则M的相对原子质量为:111-36.5×2=40,摩尔质量为40g/mol
故答案为:40g/mol;
(4)VL Fe2(SO4) 3溶液中含有ag SO4 2-,则硫酸根离子的物质的量浓度为:$\frac{\frac{a}{96}}{V}$=$\frac{a}{96V}$mol/L,则三价铁离子物质的量浓度为:$\frac{a}{96V}$×$\frac{2}{3}$=$\frac{a}{144V}$(mol/L).
设稀释后三价铁离子的物质的量浓度为C,依据稀释过程中三价铁离子的物质的量不变则:$\frac{a}{144V}$×0.5V=2V×C,
解得C=$\frac{a}{576V}$;
故答案为:$\frac{a}{576V}$.
点评 本题考查物质的量有关计算,注意对公式的理解掌握与灵活应用,侧重考查学生对基础知识掌握的熟练程度,难度不大.


科目:高中化学 来源: 题型:解答题
 +
+ $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
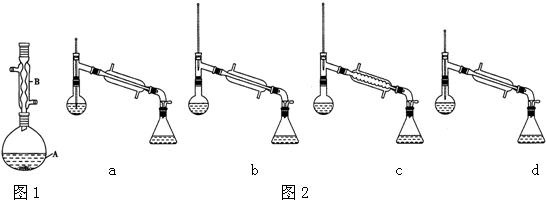
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔与酸性高锰酸钾溶液的反应 | |
| B. | 乙烯通入溴的四氯化碳溶液中的反应 | |
| C. | 在镍作催化剂、加热的条件下苯与氢气的反应 | |
| D. | 在浓硫酸作用下,苯在55℃左右与浓硝酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
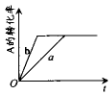 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是 ( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是 ( )| A. | 增大A的浓度或减少C的浓度 | |
| B. | 缩小容器的容积或加入催化剂 | |
| C. | 升高温度或增大压强 | |
| D. | 由a变成b,A和B的物质的量与C、D的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.12 mol•L-1 | B. | 0.1 mol•L-1 | C. | 1.2 mol•L-1 | D. | 1.0 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,它们的物质的量必相等 | |
| B. | 1 L一氧化碳气体一定比1 L氧气的质量小 | |
| C. | 28 g N2和CO的混合气体在标准状况下的体积约为22.4 L | |
| D. | 常温常压下,1 mol碳完全燃烧消耗22.4 L氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸不小心沾到皮肤上,立即用NaOH溶液洗涤 | |
| B. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| C. | 碱溶液沾到皮肤上,立即用浓酸中和并冲洗 | |
| D. | 配制硫酸溶液时,先在量筒中加入一定体积的水,再边搅拌边慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
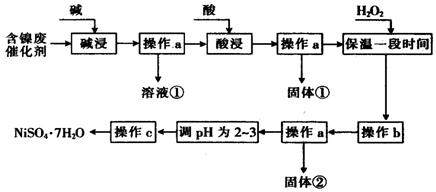
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ai(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
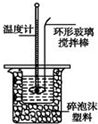 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com