
下列各项中表达正确的是( )
|
| A. | 硫离子的核外电子排布式:1s22s22p63s23p6 |
|
| B. | N2的结构式::N≡N: |
|
| C. | NaCl的电子式: |
|
| D. | CO2的分子模型示意图: |
考点:
原子核外电子排布;电子式、化学式或化学符号及名称的综合.
专题:
化学用语专题.
分析:
A.硫离子核外电子数为18,结合能量最低原理书写判断;
B.氮气分子中N原子之间形成3对共用电子对,用短线“﹣”代替共用电子对即为其结构式,未成键的孤电子对不需要标出;
C.NaCl属于离子化合物,由钠离子与氯离子构成;
D.CO2分子为直线型结构.
解答:
解:A.硫离子核外电子数为18,核外电子排布式:1s22s22p63s23p6,故A正确;
B.N2的结构式为N≡N,故B错误;
C.NaCl属于离子化合物,由钠离子与氯离子构成,其电子式为 ,故C错误;
,故C错误;
D.CO2分子为直线型结构,选项中为V型,与二氧化碳分子结构不符合,故D错误,
故选A.
点评:
本题考查常用化学用语,涉及核外电子排布、结构式、电子式、分子模型,难度不大,侧重对基础知识的巩固.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
实验室需要配制2mol/l的NaCl溶液450ml,配制时应选用的容量瓶的规格和称取的NaCl质量分别是()
A. 450ml,52.65g B. 任意规格,52.65g
C. 500 ml,58.5g D. 1000 ml,117g
查看答案和解析>>
科目:高中化学 来源: 题型:
3Cl2+8NH3=6NH4Cl+N2的反应中,被氧化的NH3与未被氧化的NH3的分子数之比为()
A. 1:6 B. 3:1 C. 1:3 D. 6:1
查看答案和解析>>
科目:高中化学 来源: 题型:
元素的性质呈现周期性变化的根本原因是( )
|
| A. | 原子半径呈周期性变化 |
|
| B. | 元素的化合价呈周期性变化 |
|
| C. | 第一电离能呈周期性变化 |
|
| D. | 元素原子的核外电子排布呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氢原子的电子云图中的小黑点表示的意义是( )
|
| A. | 一个黑点表示一个电子 |
|
| B. | 黑点的多少表示电子个数的多少 |
|
| C. | 表示电子运动的轨迹 |
|
| D. | 电子在核外空间出现机会的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中,同周期元素的结构和性质呈现一定的规律性变化.下表列出的是第三周期元素的原子半径及主要化合价(部分信息未列出).下列有关说法不正确的是( )
| 元素 | Na | Mg | ① | Si | P | ② | Cl |
| 原子的最外层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 原子半径(10﹣10m) | 1.86 | 1.60 | 1.43 | ③ | 1.10 | 1.02 | 0.994 |
| 最高正价 最低负价 | +1 | +2 | ④ | +4 ﹣4 | +5 ﹣3 | ⑤ | +7 ﹣1 |
|
| A. | ⑤处的最高正价是+6,最低负价是﹣2 |
|
| B. | ③处的数值介于1.10﹣1.43之间 |
|
| C. | 第三周期元素(Na﹣Cl)的最高正价数等于其原子的最外层电子数 |
|
| D. | 元素①的原子序数是13,①和②形成的化合物的化学式为AlS |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列装置或操作能达到实验目的(必要的夹持装置及石棉网已省略)的是()
A. 
实验室制乙烯
B. 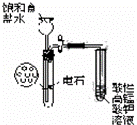
实验室制乙炔并验证乙炔发生氧化反应
C. 
实验室中分馏石油
D. 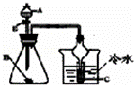
若A为醋酸,B为贝壳(粉状),C为苯酚钠溶液,验证醋酸、苯酚、碳酸酸性的强弱(不考虑醋酸的挥发)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com