
| A. | 60% | B. | 75% | C. | 80% | D. | 85% |
分析 n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,根据方程式H2+2Li=2LiH、LiH+H2O=LiOH+H2↑得0.1mol氢气反应生成LiH、LiH再和足量水反应后生成0.1mol氢气,氢氧燃料碱性电池中负极反应式为H2-2e-+2OH-=2H2O,根据电极反应式知,0.2mol氢气转移电子物质的量=0.2mol×2=0.4mol,氢氧燃料电池的能量转化率=$\frac{实际电子通过量}{理论电子通过量}×100%$.
解答 解:n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,根据方程式H2+2Li=2LiH、LiH+H2O=LiOH+H2↑得0.1mol氢气反应生成LiH、LiH再和足量水反应后生成0.1mol氢气,氢氧燃料碱性电池中负极反应式为H2-2e-+2OH-=2H2O,根据电极反应式知,0.2mol氢气转移电子物质的量=0.2mol×2=0.4mol,氢氧燃料电池的能量转化率=$\frac{实际电子通过量}{理论电子通过量}×100%$=$\frac{0.32mol}{0.4mol}×100%$=80%,
故选C.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,正确书写方程式及明确各个物理量的关系式是解本题关键,注意氢气反应生成LiH和LiH生成氢气的物质的量不相等,为易错点.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:推断题
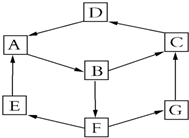 某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:
某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:| 纯A(单质) | B溶液 | D固体 | G溶液 | |
| 颜色 | 银白色 | 黄色 | 红棕色 | 浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别与其他分散系的本质特征是分散质的粒子直径在1-100nm之间 | |
| B. | 用平行光照射CuSO4溶液和氢氧化铁胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴到NaOH溶液中,一制取氢氧化铁胶体 | |
| D. | 树林中的晨曦,该现象与丁达尔效应有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | 上述反应中每生成2 mol AlN,N2得到3 mol | |
| C. | 氮化铝中氮元素的化合价为-3 | |
| D. | 氮化铝晶体属于分子晶体,熔点和沸点较低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
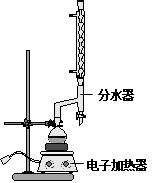 (改编)苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
(改编)苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- | |
| B. | 在由水电离出的c(H+)=1×10-12mol/L的溶液:Fe3+、ClO-、Na+、SO42- | |
| C. | 加入金属铝产生H2的溶液中:Na+、K+、SO42-、Cl- | |
| D. | 饱和氯水中:Cl-、Na+、NO3-、SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com