
【题目】在一定温度下,2 L密闭容器内,反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO))/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
该反应达到平衡状态的时间是
A.3 min
B.1 min
C.2 min
D.0 min
科目:高中化学 来源: 题型:
【题目】按要求完成下列方程式
(1)浓硫酸和碳反应的化学方程式是__________________________________________;
(2)过氧化钠与二氧化碳反应的化学方程式为______________________________;
(3)高锰酸钾溶液与浓盐酸反应的离子方程式为_____________________________;
(4)氧化铝与氢氧化钠溶液反应的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是一种白色固体,易分解,易水解,可用作肥料、灭火剂、洗涤剂等。实验室制备氨基甲酸铵的反应如下:2NH3(g)+CO2(g) ![]() NH2 COONH4(s) △H<0,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则水解生成碳酸铵或碳酸氢铵。某化学兴趣小组按下图装置进行如下实验:
NH2 COONH4(s) △H<0,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则水解生成碳酸铵或碳酸氢铵。某化学兴趣小组按下图装置进行如下实验:
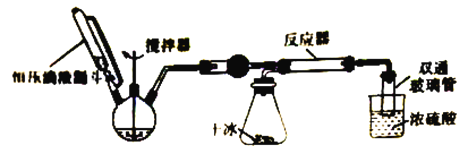
步骤1:按图连接好实验装置,____________________。
步骤2:在相应仪器中装入药品,其中1在三颈烧瓶中加入足量的氢氧化钠固体,在恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品。
……
请回答下列问题:
(1)将步骤1补充完整:________________________
(2)干燥管中盛放的药品是___________________________
(3)对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有____________________(写出一种即可)。
(4)三颈烧瓶中产生氨气的原理是________________________________。
(5)反应后期随着产生CO2气流减慢,导致反应物比例不当,可采取的措施是________________。
(6)尾气处理装置中双通玻璃管的作用是_________________(用文字叙述),浓硫酸的作用是_______________、______________。
(7)取部分变质(混有碳酸氢铵的氨基甲酸铵)样品1.173g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500g。则样品中氨基甲酸铵的物质的量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,磁性材料的研究备受国际磁学界的关注。Fe3O4具有许多优异的性能,在磁性材料等领域应用广泛。回答下列问题:
(1)水热法制备Fe3O=纳米颗粒的总反应为3Fe2++2S2O32-+O2+4OHˉ=Fe3O4+S4O62-+2H2O,下列说法正确的是_________(填字母)
A.S2O32-是氧化剂
B.被氧化的Fe2+和未被氧化的Fe2+个数之比为1:2
C.每生成1 mol Fe 3O4,则转移电子数为2mol
D.该反应中氧化剂与还原剂的物质的量之比为1:4
(2)已知:H2O(1)=H2(g)+1/2O2(g) △H1=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下:过程I的热化学方程式为2Fe3O4(s) ![]() 6FeO(s)+O2(g) △H2=+313.2kJ·mol-1,则过程II的热化学方程式为____________。
6FeO(s)+O2(g) △H2=+313.2kJ·mol-1,则过程II的热化学方程式为____________。

(3)化学共沉淀法是制备Fe3O4颗粒最常用的方法之一,方法是将FeSO4和FeCl3溶液以1:2投料比混合,再加入NaOH溶液,即可产生Fe3O4颗粒,则该反应的离子方程式为______________________,由下表数据可知,Fe2+和Fe3+的最佳投料比为1:1.85,原因可能是_____________________。
表 不同投料比得到Fe3O4的结果

(4)磁铁矿(Fe3O4)是工业上冶炼铁的原料之一,发生的主要反应为Fe3O4(s)+4CO![]() 3Fe(s)+4CO2,该反应的△H<0,T℃时,在1L恒容密闭容器中,加入Fe3O4、CO各0.5mol,10min后反应达到平衡时,容器中CO2的浓度是0.4mol·L-1。
3Fe(s)+4CO2,该反应的△H<0,T℃时,在1L恒容密闭容器中,加入Fe3O4、CO各0.5mol,10min后反应达到平衡时,容器中CO2的浓度是0.4mol·L-1。
①CO的平衡转化率是______________,T℃时,该反应的平衡常数K=__________。
②欲提高该反应中CO的平衡转化率,可采取的措施是_____________(任写一个即可)。
③其他条件不变时,该反应在不同温度下,CO2含量随时间的变化![]() (CO2)~t曲线如图所示,温度T1、T2、T3由大到小的关系是___________,判断依据是____________。
(CO2)~t曲线如图所示,温度T1、T2、T3由大到小的关系是___________,判断依据是____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂是密度最小的活泼金属,其单质及其化合物如:LiAlH4、Li2CO3、 LiPF6等有广泛的用途。工业上以锂辉石(主要成分为LiAlSi2O6,还含有硫酸钙、硫酸镁和铁的氧化物)为原料,制备Li2CO3的的工艺流程如下:
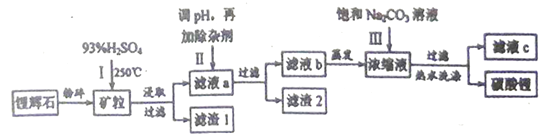
已知①LiAlSi2O6和H2SO4会生成SiO2
②
Fe3+ | A13+ | Fe2+ | Mg2+ | |
氢氧化物完全沉淀pH | 3.2 | 4.7 | 9.0 | 11.1 |
③某些物质的溶解度(S) 如下表
t/℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
请回答下列问题:
(1)LiAlSi2O6改写成氧化物的形式是___________________。
己知表中40℃Li2CO3溶解度(饱和溶液的密度为ag/cm3),则Li2CO3的溶度积(Ksp) 为________,(用含有a的代数式表示)
(2)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子 方程式为____________________。
(3)己知滤渣2 的主要成分有Mg(OH)2 。向滤液a中加入石灰乳的作用是(运用化学平衡原理简述)___________________。用热水洗涤Li2CO3固体目的是___________________。
Ⅱ.锂单质制备及其化合物的性质
1)用碳酸锂和盐酸反应得到氯化锂溶液,写出如何从氯化锂溶液得到无水氯化锂固体的实验方法__________________。
(2) 已知2Li+H2![]() 2LiH,LiH固体密度为0 8g/cm3,用锂吸收22.4L (标准状况) H2, 生成的LiH体积与 被吸收 的 H2 体积 比 为________________。
2LiH,LiH固体密度为0 8g/cm3,用锂吸收22.4L (标准状况) H2, 生成的LiH体积与 被吸收 的 H2 体积 比 为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象不能实验预期的目的是( )
A.用食醋,石灰水来验证蛋壳的成分是碳酸盐
B.用银氨溶液鉴别乙醇和乙醛
C.用酸性高锰酸钾验证苯中是否含有碳碳双键
D.用溴水鉴别乙烯和乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年9月我国科学家对于可充放电式锌一空气电池研究取得重大进展。电池装置如图所示,该电池的核心是驱动氧化还原反应(ORR)和析氧反应(OER),KOH溶液为电解质溶液,放电的总反应方程式为2Zn+O2+4OH-+2H2O=2Zn(OH)42-。下列有关说法正确的是
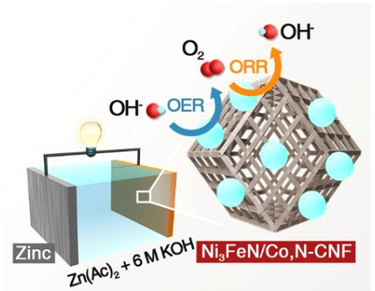
A. 可逆锌一空气电池实际上是二次电池,放电时电解质溶液中K+向负极移动
B. 在电池产生电力的过程中,空气无阻挡地进入电池,发生ORR反应,并释放电荷
C. 发生OER反应的电极反应式为2H2O-4e-=O2+4H+
D. 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com